 BTC/HKD+0.09%
BTC/HKD+0.09% ETH/HKD-0.49%
ETH/HKD-0.49% LTC/HKD-0.3%
LTC/HKD-0.3% ADA/HKD-1.22%
ADA/HKD-1.22% SOL/HKD-1.11%
SOL/HKD-1.11% XRP/HKD-0.89%
XRP/HKD-0.89%討論中國創新藥的發展,一個繞不開的存在就是百濟神州。
百濟神州是一家專注于腫瘤創新藥研究、商業化與生產的生物科技公司,其于2010年10月在北京創立,創始人為歐雷強和王曉東博士。歐雷強曾經擔任過專注腫瘤領域的生物醫藥企業Genta公司的聯席首席執行官、專注于中樞神經系統疾病療法的生物制藥企業Galenea的首席執行官,生物技術公司創業經歷豐富。
而王曉東博士的簡歷更為耀眼,王曉東1963年出生于河南新鄉,其于1985年赴美留學,1991年獲得美國德克薩斯大學西南醫學中心生物化學博士學位;2002年擔任霍華德休斯醫學研究所研究員;2003年被聘為北京生命科學研究所第一任所長;2004年當選美國國家科學院院士,是新中國培養出來的第一位獲此殊榮的科學家;2006年獲得邵逸夫生命科學與醫學獎;2013年入選中國科學院外籍院士。
因此頂級的科學+商業創始團隊讓百濟神州從誕生就注定不同凡響。公司在發展過程中,不斷得到跨國藥企背書以及頭部PE機構的加持。
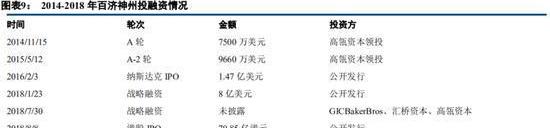
光芒背后,我們看到驅動公司的戰略是:一,高舉高打,國際化發展思路貫穿始終,全球化研發及臨床策略;二,專注腫瘤創新藥的同時通過BD注重與跨國藥企進行戰略合作,收益風險共擔。同時對國外一些biotech公司的處于開發后期的前沿新藥的國內權益進行投資,以實現彎道超車。
隨著公司的發展,公司的BD策略被證明是十分成功的:與安進的合作成功的分散了風險,增厚了管線,同時對LEAP公司DKN-01和ymeworks公司ZW49的投資都廣受好評。
但是公司全球化研發臨床的策略,卻帶來了被廣泛詬病的財務問題:公司燒錢的速度實在太快,與此同時,收入產出似乎不成正比,一方面公司研發支出比恒瑞多一倍,但管線厚度卻不及;另一方面,公司大量投入國際臨床資源的PD-1和BTK產品均非FIC,且公司BTK澤布替尼和FIC伊布替尼在華氏巨球蛋白血癥的頭對頭臨床試驗中失敗,顯示并沒有優效性更是加重市場疑慮,百濟高舉高打的燒錢戰略,是否真的合理?
本文旨在梳理百濟神州的行業現狀、財務情況、腫瘤管線來說明公司未來發展的機遇和存在的問題。同時梳理百濟管線,百濟未來的跟蹤核心要點是:一,BTK澤布替尼在慢性淋巴細胞白血病這一核心適應癥進展;二,PD-1替雷利珠單抗在肺癌、胃癌核心適應癥進展;三,公司研發支出是否能夠匹配公司BTK和PD-1兩大產品商業化進展,研發支出是否依然超高速增長引起公司資產負債表惡化。
下面是具體的分析。
行業分析:腫瘤創新藥行業需求和滲透率的不斷提升
得益于頂級的創業團隊,百濟神州從創立就瞄準了一條黃金賽道:腫瘤創新藥。
根據弗若斯特沙利文預計,2019-2023年全球藥物市場CAGR約5%,2023年達約1.6萬億美元,全球腫瘤市場CAGR約為11%,2023年達2500億美元,占全球藥物市場的16%,明顯高于全球處方藥市場增速。
全球腫瘤市場高速發展,中國腫瘤市場增速更快。2019-2023年中國藥物市場CAGR約7%,2023年達3220億美元,中國腫瘤市場CAGR為14%,2023年達450億美元,占中國藥物市場的14%,明顯高于全球腫瘤市場增速。
Coinbase首席法務官:美國聯邦第三巡回上訴法院已詢問SEC是否會拒絕Coinbase此前提出的規則制定申請:6月7日消息,據 Coinbase 首席法務官 Paul Grewal 在社交媒體透露,美國聯邦第三巡回上訴法院今天已對 Coinbase 的強制執行令(mandamus action)發布了一份短期命令(short order),其中提到該法院已經注意到美國證券交易委員會(SEC)對 Coinbase 提起的訴訟,而且已經詢問了 SEC 發起對 Coinbase 訴訟是否意味著會拒絕 Coinbase 此前針對未決規則制定向 SEC 提出的申請,美國證券交易委員會有 7 天時間做出回應。
Paul Grewal 稱,Coinbase 認為,如果美國證券交易委員會尚未決定是否拒絕規則制定申請,就不應該提起訴訟,立法或規則制定必須先于執法行動。如果 SEC 對 Coinbase 提出規則制定請求的回答是否,那么 Coinbase 有合法權利在法庭上質疑這個否,同時還會有一些嚴肅的問題要詢問 SEC。Coinbase 對美國聯邦第三巡回上訴法院關注此事表示感謝。[2023/6/7 21:21:14]
而未來中國腫瘤藥市場的高增速可能進一步加速,主要有三個原因。
1,我國腫瘤藥需求不斷增加,市場不斷擴容。
根據國家癌癥中心統計顯示,2010年我國腫瘤歷年發病人數為235.23/10萬人,2015年為285.83/10萬人,五年間CAGR達3.97%,我國惡性腫瘤新發患者數CAGR增速較高。
2,我國對惡性腫瘤治療方式以化療為主,因此療效更好的免疫療法和靶向治療滲透率增加是必然。此外,免疫療法和靶向治療的普及料將普遍延長腫瘤患者生存率,存量用藥需求可能擴大。
過去我國對惡性腫瘤的治療方式還是以傳統化療為主,免疫療法和靶向治療方向的腫瘤創新藥滲透率較低。根據弗若斯特沙利文統計顯示,在中國銷售額前十大腫瘤藥物中有5種是化療藥物。根據GEN雜志統計顯示,2018年全球十大暢銷腫瘤藥物中有8種是分子靶向藥或腫瘤免疫治療藥物,無一是化療藥物。
此外,根據國家癌癥中心統計,2015年中國五年生存率為37.20%,而美國2015年美國五年生存率為67%。中國五年生存率仍有望不斷提高。預計未來我國需用藥的腫瘤患者人數將維持增長。
3,政策支持腫瘤創新藥參加醫保談判,未來腫瘤創新藥可及性可能大大增強。
2019年,信迪利單抗以降幅64%的價格成為唯一一家進入國家醫保的PD-1產品。考慮到biotech較傳統國內醫藥巨頭銷售方面的劣勢,通過適當降價進醫保可能讓管線迅速放量。
因此,考慮到行業需求和滲透率的不斷提升,再加上政策的扶持,腫瘤創新藥賽道說是一條黃金賽道也不為過。不過正因為這是一條黃金賽道,導致公司的要面對的競爭也非常激烈。
百濟財務分析:四年研發費用高達135.4億元
公司仍處商業化早期階段,核心管線產品BTK抑制劑澤布替尼2019年11月在美國上市、PD-1抗體藥物替雷利珠單抗2019年12月底在中國上市,因為核心產品剛上市不久,還未能提供實際收入,因此公司當前收入主要來自專利授權、商業違約金和新基三款授權商業化產品。
2017年,百濟神州與跨國藥企血液腫瘤龍頭公司新基的交易,將其PD-1替雷利珠單抗的部分海外權益的出售給新基,獲得了新基2.63億美元的預付款、1.50億美元的股權投資以及新基三個商業化產品在中國的權益。之后這筆交易在2019年因新基被百時美施貴寶收購而終止,公司收到1.5億美元違約金并收回替雷利珠單抗全球開發及商業化權利,但百濟神州依然保留了新基三個商業化產品的中國運營權。
數據:ParaFi Capital于2小時前將1206枚MKR轉入Coinbase:金色財經報道,據 Spot On Chain 數據顯示,區塊鏈投資公司 ParaFi Capital 通過地址開頭為 0xD9B 的中間錢包于 2 小時前將 1206 枚 MKR 轉入 Coinbase,均價 699.62 美元(合計 84.4 萬美元)。[2023/5/3 14:39:54]
公司的收入主要即來自新基的三款商業化產品的中國運營銷售收入。此外百濟神州通過預付授權費、研發開發報銷、研發服務的方式獲得合作收入。
2018年,公司實現營業收入13.6億元,同比下降16.85%,主要原因是當年未能獲得藥品轉讓授權的預付款。其中凈產品收入高速增長463%,但由于研發投入增多,2018年公司歸母凈利潤為-46.2億元,同比虧損加大。
2020年3月3日,百濟神州公布2019年業績報告。全年收入4.3億美元,同比增長116%,主要原因是與新基就終止合作協議獲得的1.5億美元和以及產品收入的增加。其中,全年產品收入2.2億美元,較2018年同比增長70%,保持高速增長。不過考慮2019年百濟神州研發投入高達9.27億美元以及銷售、一般及行政管理費用為3.9億美元,公司歸母凈利潤為-9.49億美元,同比虧損進一步加大。
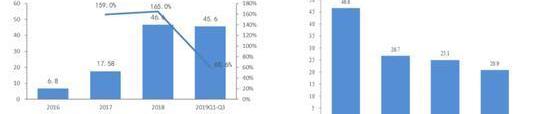
2016年至2019年,百濟神州年研發費用分別為6.8億元、17.5億元、46.4億元和64.7億元。2016年以來,公司累計投入研發費用高達135.4億元。
對于高昂的研發費用,百濟相關人士稱:“2019年一共開展了15個三期臨床試驗,其中全球性的臨床試驗有9個,因此大規模的臨床試驗帶來了研發投入的增加。”
百濟年報則稱:高昂的研發費用主要歸因于澤布替尼和替雷利珠單抗關鍵性臨床試驗持續進行的患者入組和擴展,后期候選藥物的注冊登記,商業化前生產和供應,以及臨床前項目的擴展。
綜上可知百濟高額的研發費用主要是花在了澤布替尼和替雷利珠單抗的臨床試驗上,因此我們在管線分析中也會著重分析這兩款藥物的前景,是否能收回高昂的研發成本。
百濟腫瘤管線分析:BTK頭對頭失敗PD-1面臨強烈競爭
百濟神州的管線布局主要分為自研以及合作兩部分。
1百濟自研管線。
百濟神州產品主要包括5種內部開發藥物,分別為:血液腫瘤領域的澤布替尼于2019年11月FDA獲批;PD-1抗體藥物替雷利珠單抗2019年12月底在中國獲批上市;3款在研藥物:卵巢癌、乳腺癌領域的新藥Pamiparib正在全球開展III期臨床;PD-L1單抗和Raf抑制劑正在開展全球I期臨床,由于這兩項藥物處于開發早期,故我們暫時不對其進行深入分析。
1.1澤布替尼
2019年11月,澤布替尼獲得FDA批準上市治療復發難治的套細胞淋巴瘤,成為第一個在美獲批上市的中國自主研發抗癌新藥。
澤布替尼為Bruton酪氨酸激酶抑制劑。BTK是B細胞抗原受體信號通路中的關鍵激酶,B細胞惡性癌變是導致血液瘤的直接原因,而靶向殺死癌變的B細胞,就可以控制血液瘤的發展阻斷BCR誘導的BTK活化及其下游信號傳導,從而抑制某些惡性B細胞的生長,最終可造成B細胞的死亡。
加密資產開發生態平臺Circularr獲GEM的5000萬美元投資承諾:金色財經報道,加密資產開發生態平臺Circularr宣布獲得GEM的5000萬美元投資承諾,GEM將為 Circularr 提供流動性和資源,以進一步開發和試點其MRF解決方案,并激勵整個生態系統的用戶。Circularr 是一個區塊鏈生態系統,通過孵化和開發以回收商品為基礎的生態友好型加密資產來促進代幣化回收基礎設施的可持續發展。(einnews)[2023/1/30 11:37:02]
而BTK抑制劑的主要治療領域就是B細胞非霍奇金淋巴瘤。淋巴瘤分為霍奇金淋巴瘤和非霍奇金淋巴瘤。非霍奇金淋巴瘤占所有淋巴瘤患者的比例約為86%。B細胞非霍奇金淋巴瘤占約占非霍奇金淋巴瘤的76%。主要包括彌漫性大B細胞淋巴瘤、濾泡性淋巴瘤、邊緣區淋巴瘤、小淋巴細胞淋巴瘤/慢性淋巴細胞白血病、套細胞淋巴瘤。
艾伯維和強生公司旗下的伊布替尼作為全球首款BTK抑制劑,2013年美國上市。迄今為止,伊布替尼已獲批5種B細胞血液瘤以及包括慢性移植物抗宿主病在內總共6種疾病領域。自上市以來,伊布替尼全球銷售額快速上升,2018年的全球銷售額達44.54億美元。伊布替尼也是國內目前唯一獲批的BTK抑制劑。2017年8月國內獲批適應癥為二線治療套細胞淋巴瘤和二線治療小淋巴細胞淋巴瘤/慢性淋巴細胞白血病,其中SLL/CLL于2018年7月成為一線治療方案。
阿斯利康公司的阿卡替尼于2017年10月獲FDA批準上市用于治療套細胞淋巴瘤,是全球第2個上市的BTK抑制劑。與伊布替尼相比,阿卡替尼具有更好的選擇性且副作用較小,目前阿卡替尼處放量初期,2018年銷售額為6200萬美元,2019年前三季度1.08億美元,銷售額增長迅速。
澤布替尼則是百濟神州自主研發的第二代BTK抑制劑。澤布替尼作為新型的BTK抑制劑相對于伊布替尼和阿卡替尼具有一定的治療優勢,有更高選擇性降低“脫靶”效應以及更高的安全性。
2019年11月15日,美國FDA宣布澤布替尼以“突破性療法”、“優先審評”獲準上市,用于治療既往接受過至少一項療法的成年套細胞淋巴瘤患者。不過套細胞淋巴瘤發病人數較少,中國每年MCL新發病例數約為1000例,而美國則約為3000例。
因此澤布替尼的核心還是未來適應癥的拓展,其中重點是小淋巴細胞淋巴瘤/慢性淋巴細胞白血病。SLL和CLL是歐美較常見的一種血液系統腫瘤,美國的發病率約為4.5/10萬,可由伊布替尼單藥或與奧比妥珠單抗聯合治療。目前,約有50%的CLL新患者正在使用BTK抑制劑治療。而澤布替尼對SLL和CLL的臨床試驗尚處于早期,需要持續跟蹤。
另外澤布替尼正在拓展的適應癥包括濾泡性淋巴瘤和彌漫大B細胞淋巴瘤。目前,對于FL,百濟神州正在進行一項澤布替尼+阿妥珠單抗聯合用藥與阿妥珠單抗單藥治療的頭對頭全球II期臨床試驗。濾泡性淋巴瘤約占B細胞非霍奇金淋巴瘤的10-20%。2018年美國約有14000名新診斷的FL患者,中國約5600名。目前,對于DLBCL,百濟神州的臨床研究處于劑量擴展的II期。彌漫大B細胞淋巴瘤是非霍奇金淋巴瘤中占比最高的亞種,占比達40%。這兩個適應癥的進展依然需要跟蹤。
此外,因為伊布替尼有一定的耐藥問題,所以與伊布替尼的競爭中,百濟開展了澤布替尼各種聯合用藥的臨床試驗。澤布替尼聯合Obinutuzumab用于治療FL適應癥已經開展全球II關鍵臨床試驗。澤布替尼聯合替雷利珠單抗治療B細胞淋巴瘤已經開展全球Ib期臨床試驗。公司還計劃開展澤布替尼聯合利妥昔單抗用于一線治療MCL的全球III期臨床試驗。
Sui基金會網站已上線,并開放開發者Grant申請入口:10月25日,據官方消息,Sui基金會網站已上線,并開放開發者Grant申請入口。Sui的開發者資助金額將從1萬美元至10萬美元不等,并可能會給予額外的SUI代幣獎勵。[2022/10/25 16:38:30]
澤布替尼在中國也已有兩項適應癥提交NDA申請并獲得優先受審權,包括復發/難治性套細胞淋巴瘤、復發/難治性慢性淋巴細胞白血病/小淋巴細胞淋巴瘤。不過考慮到澤布替尼已批和在研適應癥在中國的患者比例較小,因此澤布替尼的核心在于針對美國患者的適應癥拓展以及聯合用藥臨床試驗的進展。
競爭格局方面,目前全球約有22家藥企開展BTK抑制劑臨床研究,其中伊布替尼、阿卡替尼、澤布替尼獲批上市,奧布替尼正處于中國NDA階段。
此外,澤布替尼和伊布替尼在華氏巨球蛋白血癥的臨床試驗中顯示并沒有優效性。盡管澤布替尼獲得更高的VGPR+CR,但未達到統計學顯著。ASPEN試驗是首個比較兩個BTK抑制劑療效的III期隨機臨床試驗,該試驗主要臨床終點是VGPR+CR率,其中試驗組澤布替尼組VPGR+C率為28.9%,對照組伊布替尼組VGPR+CR率為19.8%。雖然試驗組獲得更高的VGPR+CR率,遺憾的是P值為0.0116,未達到統計學顯著,因而未達到主要臨床終點。
值得注意的是ASPEN試驗被認為是較為激進的,因為其證明的是相對FIC伊布替尼的優效性而不是非劣性。有市場評論稱,百濟作為biotech,相對于艾伯維與阿斯利康這種擁有強大本土市場銷售實力的具有先天劣勢,只能激進的證明優效性以破局,而ASPEN試驗的失敗則為澤布替尼未來的商業化蒙上了一層陰影,趕超FIC可能機會不大。
不過,華氏巨球蛋白血癥和澤布替尼已經獲批的套細胞淋巴瘤都是相對較小的適應癥,而慢淋白血病適應癥中頭對頭與伊布替尼以及慢淋白血病一線的臨床結果對于澤布替尼未來的商業化前景更有決定性影響。
澤布替尼在CLL適應癥與伊布替尼進行頭對頭比較,該試驗名稱為ALPINE,于2018年11月啟動,計劃入組400人,主要終點為ORR。預計該試驗將于2020年完成。伊布替尼與慢淋白血病一線目前處于臨床III期。
總而言之,澤布替尼適應癥布局廣泛,未來CLL、FL和DLBCL適應癥的拓展,與利妥昔單抗等聯合用藥臨床試驗的進展都會對澤布替尼未來商業化前景影響巨大,其中CLL適應癥與伊布替尼和苯達莫司汀+利妥昔單抗的頭對頭結果更是核心關鍵,考慮到國際臨床試驗的巨大成本,百濟已經為此投入的龐大研發成本,這一頭對頭試驗某種程度上對百濟來說,只能成功,不能失敗。如果失敗,股價劇烈調整可能就在眼前。不過值得一提的是,也有市場分析人士認為百濟一線CLL與苯達莫司汀+利妥昔單抗的頭對頭并無意義,與Obinutuzumab+Chlorambucil對標更為合適。
1.2替雷利珠單抗
替雷利珠單抗注射液是一款人源化IgG4抗PD-1單克隆抗體,設計目的是為避免與巨噬細胞表面效應細胞FcγR結合進而激活巨噬細胞的吞噬作用,以減少其對T-效應細胞的負面影響。替雷利珠抗體是目前唯一在恒定區Fc段進行改造的PD-1抗體。與其他PD-1抗體相比,替雷利珠單抗最大的不同在于其在抗體恒定區進行的改造,通過最大限度地減少與具有Fcγ受體的II型巨噬細胞結合來提高PD-1抗體的抗腫瘤活性,同時可以最大程度地減少與其他免疫細胞的潛在負面相互作用。
MicroStrategy成為首家在富達注冊比特幣401(k)養老金賬戶的公司:7月25日消息,今年四月,富達投資宣布允許投資者通過專用“數字資產賬戶”在他們的401(k)養老金賬戶中存入比特幣,據悉MicroStrategy是第一家在富達注冊比特幣401(k)養老金賬戶的公司,富達表示已經看到雇主的強烈興趣,預計未來會有更多企業跟進。
另據知情人士透露,考慮將比特幣添加到401(k)計劃中的雇主需要進行盡職調查并獲得必要的批準,富達只需要大約90天時間即可完成。(Barrons)[2022/7/25 2:36:37]
2019年12月28日,百濟神州公告:公司抗PD-1抗體藥物替雷利珠單抗注射液獲NMPA批準用于治療至少經過二線系統化療的復發或難治性經典型霍奇金淋巴瘤患者,成為國內上市的第6款PD-1藥物。
經典型霍奇金淋巴瘤約占霍奇金淋巴瘤的95%。隨著標準一線化療方案的廣泛應用,cHL患者的5年生存率已有明顯改善。但仍有15%-30%的患者經過一線治療后復發或難治。而替雷利珠單抗在R/RcHL關鍵性II期臨床試驗研究結果顯示,基于獨立評審委員會進行評估的客觀緩解率為76.9%,其中完全緩解率為61.5%。替雷利珠單抗在霍奇金淋巴瘤適應癥單臂試驗中顯示出同類最高完全緩解率。
2019年5月,NMPA受理了替雷利珠單抗尿路上皮癌適應癥上市申請,后者成為該適應癥國內唯一一家NDA的PD-1產品。尿路上皮癌是我國最常見的泌尿系統惡性腫瘤之一,替雷利珠有望成為獲批該適應癥的首個國產PD-1藥物。我國尿路上皮癌患者池為7.2萬人/年,有券商測算對應市場規模為19.56億元。
肺癌是發病率和死亡率均列第一位的癌癥,我國每年肺癌發病約78.1萬人,死亡病例約62.6萬人。此外消化道腫瘤亦是我國主要的惡性腫瘤。面對核心適應癥,替雷利珠單抗正在全球范圍內作為單藥療法及聯合療法開發布局在肺癌和消化道腫瘤的臨床試驗,其中替雷利珠單抗針對一線鱗狀非小細胞肺癌臨床III期已經成功,小細胞肺癌和二線非小細胞肺癌均已進入臨床III期;針對肝癌一線、一線/二線食管鱗癌和一線胃癌也均已在全球開展臨床III期實驗。
目前在中國肺癌患者中,晚期非小細胞肺癌患者占總肺癌患者的70%-80%。針對肺癌多亞型的治療方案仍然是臨床未被滿足的需求。2020年1月21日,百濟神州宣布替雷利珠單抗聯合兩項化療方案用于治療一線鱗狀非小細胞肺癌患者的關鍵3期臨床試驗在計劃的期中分析中,經獨立評審委員會評估,達到提高無進展生存期這一試驗主要終點。
考慮到百濟神州替雷利珠單抗治療效果優異且核心適應癥布局全面,有券商預測公司的PD-1銷售峰值有望達到82億元。
不過值得注意的是,預計今年阿特珠單抗和德瓦魯單抗同樣獲批,屆時國內市場將形成4個進口產品和4個本土產品的充分競爭市場格局,而且Keytruda已獲得三項肺癌一線的上市批準。2020年3月,恒瑞卡瑞利珠單抗二線肝癌適應癥上市申請也獲得NMPA批準。此外去年,信達生物的信迪利單抗更是超預期降價64%進入國家醫保。
也就是說,今年替雷利珠單抗將同時面臨賽道擁擠、競爭對手適應癥拓展領先和醫保談判降價的壓力,公司是否一定會在PD-1市場取得較好經營成果,其實存在一定的不確定性。
1.3PamiparibPARP抑制劑
Pamiparib是百濟研發的PARP抑制劑。2013年10月,百濟神州將兩個在研產品Pamiparib、Lifirafenib海外權益出售給德國默克,獲得里程碑款6.65億美元。2015年10月,公司從德國默克回購了Pamiparib海外權利。
目前Pamiparib多項臨床試驗正在開展當中,進入臨床III期的有一線鉑敏感胃癌和二線鉑敏感復發性卵巢癌維持治療。不過由于入組低于預期,百濟已經把Pamiparib對一線鉑敏感胃癌臨床研究降為II期。
PARP指聚腺苷二磷酸核糖聚合酶對DNA損傷修復發揮作用,目前PARP最主要的治療機制是BRCA1/2突變細胞的合成致死。合成致死是指DNA鏈受到損傷時,PARP-1和BRCA1/2蛋白會共同修復受損DNA鏈。BRAC突變主要生在在乳腺癌和卵巢癌患者,前列腺癌、胃癌等實體瘤也均有涉及。從患者群體來看,PARP抑制劑的應用前景十分廣泛。且隨著聯用方案及適應癥拓展,PARP抑制劑有望成為小分子廣譜抗癌藥,具備良好的市場前景。
目前全球有四款PARP抑制劑,主要用于治療卵巢癌及乳腺癌。包括奧拉帕利、盧卡帕利、尼拉帕利和他拉唑帕利。全球首款PARP抑制劑――阿斯利康的奧拉帕利于2014年12月獲FDA批準上市,于2018年8月獲得NMPA批準進口上市。2018年奧拉帕利全球銷售額為6.47億美元,同比增長118%。
目前國內PARP抑制劑處于起步階段,除阿斯利康PARP制劑奧拉帕利外,暫無國產產品上市。國產PARP抑制劑中,恒瑞醫藥的氟唑帕利已經申報NDA、百濟神州BGB-290膠囊、再鼎醫藥Niraparib膠囊進入臨床3期,其余均處于臨床早期階段。
有券商假設PARP抑制劑在卵巢癌、乳腺癌、前列腺癌、胰腺癌的滲透率達到50%,非小細胞肺癌、尿路上皮癌滲透率達到10%,Pamiparib市場份額在15%-20%之間,預計其銷售峰值將達到34億元。
2合作管線
百濟神州除了自有管線外還存在大量合作管線,這些合作管線又分為兩種模式:一是海外制藥巨頭企業的戰略合作;二是通過BD團隊對國外一些biotech公司的處于開發后期的前沿新藥的國內權益進行投資。
2.1巨頭戰略合作
百濟神州從創立之初就十分重視與國際醫藥巨頭的合作。
2013年,百濟神州將兩個在研產品Pamiparib、Lifirafenib海外權益出售給德國默克,獲得里程碑費用6.65億美元,解決了公司發展初期資金問題。
2017年,百濟神州完成與新基的交易,將其PD-1替雷利珠單抗的部分海外權益的出售給新基,獲得了新基2.63億美元的預付款、1.50億美元的股權投資以及新基三個商業化產品在中國的權益及1種在研藥物在中國區的授權許可,這筆交易在2019年因新基被百時美施貴寶收購而終止,但百濟神州依然保留了三個商業化產品的中國運營權,且獲得1.5億美元的違約金。
2019年,百濟神州與跨國制藥公司安進進行戰略合作,百濟神州獲得27億美元股權融資、獲得安進三個商業化產品地舒單抗、卡非佐米、倍林妥莫雙抗在中國5-7年的部分商業化權益,在此期間,兩家公司將平等分享利潤和損失。同時獲得在全球范圍內與安進共同開發其腫瘤領域20個在研產品的權益。
未來,安進在研的20款抗腫瘤藥物如果有任何一款在中國獲批上市,百濟神州將會在獲得批準后長達7年的商業化權利,并可以永久保留總計至多6款藥物的中國權益。雙方于商業化期間平分利潤和和虧損。商業化期滿后,百濟神州有權保留一種產品,并獲得未保留產品額外5年的在中國的特許使用費。百濟神州將與安進共同承擔全球范圍內的開發費用,合作期間貢獻的開發服務和現金總價值至多為12.5億美元。
目前地舒單抗已于中國獲得批準,而卡非佐米和倍林妥莫雙抗正處于后期臨床開發階段和NDA階段。通過與安進的合作,百濟神州在2020年預計將擁有8款商業化產品和30個以上的在研品種。
百濟神州之前因為全球臨床策略已經消耗了大量研發資金,而通過與安進的合作一方面獲得了商業化所需的資金,一方面公司獲得了安進的商業化和在研產品的權益,大大增強了公司的管線厚度,可謂是神來之筆。
具體到安進的三個商業化產品地舒單抗、卡非佐米、倍林妥莫雙抗上。
地舒單抗海外適應癥為多發性骨髓瘤及實體骨瘤轉移、骨巨細胞瘤和高鈣血癥。同成分的另一商品名藥品Prolia的適應癥為:骨質疏松癥等。有券商測算地舒單抗可能在中國實現約20億元峰值銷售。
卡非佐米是一種蛋白酶體抑制劑,海外適應癥為復發或難治性多發性骨髓瘤。有券商測算卡非佐米有望實現接近10億元峰值銷售額。
倍林妥莫雙抗是一種抗CD19x抗CD3雙特異性抗體,用于微小殘留病+前體B細胞急性淋巴細胞白血病和復發或難治性前體B細胞急性淋巴細胞白血病的治療。其治療領域較窄,有券商測算其峰值銷售額約為2億人民幣。
總而言之,與國際制藥巨頭的戰略合作貫穿百濟發展始終,顯著的帶動了公司的發展和管線厚度,而且使公司在重磅產品未能商業化前期能夠繼續保持高額研發支出,降低了公司的風險。
2.2biotech產品合作
公司在與國際制藥巨頭的戰略合作的同時,公司也很重視與biotech公司通過產品引進達成產品合作,布局潛力產品并增強與自有管線聯用協同。
公司從Mirati引進Sitravatinib在亞洲、澳大利亞和新西蘭地區開發、生產和商業化獨家權益,Sitravatinib是一款在研VEGF抑制劑,與公司核心產品替雷利珠單抗聯用有望在多個適應癥解決PD-1不應答及PD-1耐藥患者的需求。
百濟還引進Zymeworks的ADC藥物ZW25、ZW49,布局乳腺癌領域潛在Best-in-Class的HER2抗體類及HER2抗體-ADC類藥物。公司還引進了BioAtlas的條件性激活CTLA-4單抗,解決PD-1與CTLA-4聯用的性及耐受問題。
同時公司還會引進一些罕見病特效藥的中國權益,司妥昔單抗和地努圖希單抗。其中司妥昔單抗用于治療多中心性巨大淋巴結增生癥,地努圖希單抗用于治療兒童高風險神經母細胞瘤。百濟還與Leap公司合作了DKN-01項目,DKN-01聯合帕博利珠單抗主要二線治療胃癌。
值得肯定的是,百濟通過與biotech公司產品合作,一方面布局了ZW49等潛力產品,一方面從聯用協同的角度完善了自有管線,優秀的BD能力值得肯定。
做空始末與戰略問題
去年9月,做空機構JCapitalResearch發布對百濟神州做空報告,稱其虛增了60%的銷售收入。JCapitalResearch對百濟的核心指控認為其存在以廣州百濟神州為主體進行的返銷行為。事后百濟否認了相關指控,給出了廣州公司的相關信息并且對2017年Q4銷售數據進行了解釋。
但是也有一些問題值得重視。公司龐大的研發支出轉化效率問題可能是百濟所有問題的核心。對于研發效率問題,百濟用研發費用和三期臨床數量的對比來說明公司的研發效率。
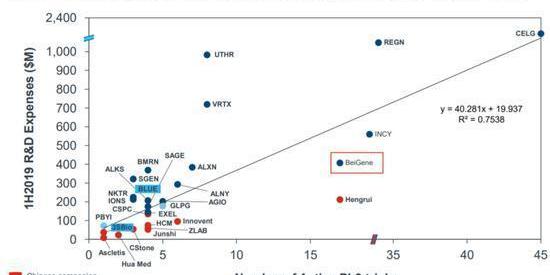
如上圖所示:可以看出百濟和恒瑞臨床三期數量接近,但是百濟研發費用接近恒瑞的二倍。而且與恒瑞相比,百濟的一二期臨床試驗較少,也就是說考慮到一二期數量的話,百濟的單位研發效率更低。考慮到公司BTK與PD-1均非FIC產品,百濟在拓展適應癥臨床試驗上砸下重金,未來投入產出比是否能夠保證?而且與FIC伊布替尼在華氏巨球蛋白血癥頭對頭試驗的失敗已經為公司未來商業化前景蒙上了些許陰影。那么回過頭來看,百濟當初高舉高打,全球研發和臨床的戰略是否合理或仍需思考。
此外,由于國內醫保談判和采集的推進,百濟目前從新基處獲得的管線亦面臨較大降價壓力。其中百濟神州首席財務官兼首席戰略官梁恒在做空澄清電話會上表示,在新基的三個產品當中,來那度胺由于納入國家醫保,價格已經有較大幅度下降。
2020年1月,白蛋白紫杉醇在第二批國采談判中價格也大幅下調。因此未來百濟已有商業化管線可能面臨一定壓力,在商業化受影響背景下,公司在資本支出方面是否應該更加審慎呢?希望未來百濟能給出更好的答卷。
不過,盡管公司巨虧,股東損失嚴重,但是百濟管理層卻已經開始套現。JCapitalResearch指出管理層似乎對百濟神州的信心不足,因為自股票禁售期滿以來,公司高管和董事共拋售了3.22億美元的股票,僅CEO就賣出了1.885億美元的股票。
對此項指控,百濟神州首席財務官兼首席戰略官梁恒則強調,管理層已出售的股票比做空報告所聲稱的要少一半。在這份報告中被列出的管理層和董事會成員,只出售了約為總持股的18%。CEO歐雷強僅賣出了總持股的16%。在售出之后,他仍然持有公司10%的股權。CEO和其他的管理層,都有很多并將持續持有公司的股權。管理層權益與投資人的權益都是一致的。
來源:新浪財經
大年三十快要到了,在北方年夜飯有吃餃子的習慣,可以沒有大魚大肉,但是一頓餃子必須要吃。正確的吃餃子的時間是大年三十晚上十二點跨年的時候,寓意著新舊交替,歲月交子.
1900/1/1 0:00:00Billions項目組《元氣騎士》這款隨機地牢闖關的游戲,深受資深老玩家的喜愛,比如說我這樣的.
1900/1/1 0:00:00今天一早,在低位徘徊了好久的比特幣,突然就沖破了8000+美元,小鹿估摸著又有什么大事件發生了吧,果然早間新聞一點開,伊朗炮轟美軍基地!其實隨著美伊關系的緊張,這段時間比特幣的價格相當的有沖勁.
1900/1/1 0:00:00ESO/VVV調查/D.Minniti太陽系已經存在了很長時間。第一個星際游客是被稱為''Oumuamua的小行星,在2017年成為頭條新聞,但它剛剛過去.
1900/1/1 0:00:00北京高碑店東側的一家偏僻的咖啡廳,筆者見到了張若蘭,明顯比照片上顯得消瘦,眼睛里依稀有血絲,但無法隱藏那份明亮。我們坐下來,開始各自打開手機,開始聊天,她說她又熬夜了,熬到了凌晨三點多.
1900/1/1 0:00:00來源:東方財富網 原標題:華潤醫藥(03320.HK):原發性高血壓藥品“纈沙坦膠囊”獲通過一致性評價 Tezos基金會支持的畫展將展出由人工智能生成的Allen Ginsberg詩集:金色財經.
1900/1/1 0:00:00