 BTC/HKD+0.09%
BTC/HKD+0.09% ETH/HKD-0.46%
ETH/HKD-0.46% LTC/HKD-0.21%
LTC/HKD-0.21% ADA/HKD-1.36%
ADA/HKD-1.36% SOL/HKD+0.17%
SOL/HKD+0.17% XRP/HKD-0.6%
XRP/HKD-0.6%1.“生物導彈”開啟創新藥新時代
1.1.ADC作用機理及發展史
抗體偶聯藥物由單克隆抗體、連接子和載藥三部分構成,ADC通過單克隆抗體特異性地結合腫瘤細胞表面高表達的靶抗原,形成ADC-抗原復合物,然后通過網格蛋白介導的內吞作用進入細胞,使載藥進入腫瘤細胞發生藥力從而殺死腫瘤細胞。ADC藥物兼具抗體的高特異性和細胞素的高抗腫瘤活性,同時因其定向釋放的特性,安全性更加可控,是目前腫瘤治療領域的熱點研究方向之一。
自1910年免疫學之父PaulEhrilich提出“魔法子彈”的概念,伴隨雜交瘤技術、單克隆抗體技術、重組蛋白質工程技術等的成熟,輝瑞于2000年推出全球首款上市的ADC藥物Mylotarg,后因嚴重副作用陷入撤市風波后整個ADC研發領域不溫不火,自2019年以來全球已獲批9款ADC藥物,整個領域迎來爆發期,至此已歷經百年。
1.2.靶抗原、抗體、載藥、連接子以及偶聯方式是構成ADC的五大要素
開發ADC藥物具有較高的技術壁壘,需要綜合考慮靶抗原、抗體、載藥、連接子以及偶聯方式多個因素,具體來說:
1.2.1.靶抗原
靶抗原為ADC識別腫瘤細胞提供了導航方向,是ADC藥物開發首先要考慮的因素,具體來說理想的抗原具有以下幾個特征:
特異性:靶抗原應僅在或主要在腫瘤細胞中表達,而在正常組織中不表達或表達很少,以降低脫靶性,而且靶抗原應為腫瘤細胞表面抗原而非細胞內抗原,以便被ADC所識別。
非分泌性:分泌的抗原會結合血液循環中的ADC,這樣會減少與病灶部位腫瘤結合的ADC,從而導致對腫瘤靶向性降低并增加安全性問題。
可有效內化:ADC藥物的抗體識別靶抗原后在受體介導下經細胞本身的內吞作用使ADC-抗原復合物進入腫瘤細胞內部。
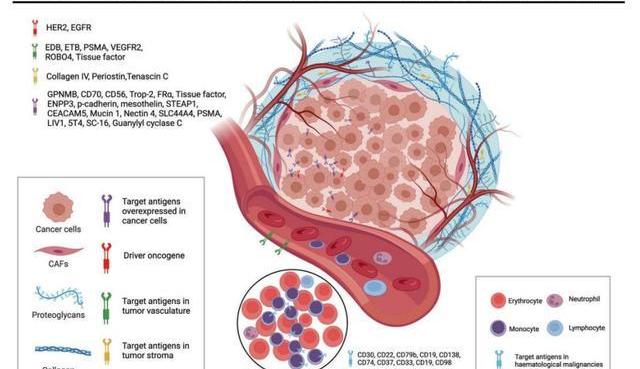
目前獲批的ADC藥物的靶抗原通常是癌細胞過表達的特異性蛋白,如針對實體瘤的靶點HER2、Trop2、Nectin4和EGFR,針對血液瘤的靶點CD19、CD22、CD33、CD30、BCMA和CD79b。隨著腫瘤學和免疫學基礎研究的不斷深入,ADC靶抗原的選擇已逐漸從傳統的腫瘤細胞抗原擴展到腫瘤微環境中的靶標。臨床前和臨床研究的最新證據顯示:新生血管系統、內皮下細胞外基質和腫瘤基質的成分可能是ADC藥物開發有價值的靶抗原。例如,基質靶向ADC藥物有可能通過降低基質駐留細胞產生的生長因子濃度而導致癌細胞死亡。ADC通過靶向癌細胞存活所依賴的血管生成因子和基質因子,可能具有更廣泛的功效。而且產生這些因子的細胞的基因組比癌細胞的基因組更為穩定,這可以為降低突變引起的耐藥性提供一種有希望的手段。
1.2.2.抗體
抗體承擔導航及素載體功能,對于ADC藥物的療效、藥代動力學、藥效學特征有重要影響。為了降低免疫原性,抗體來源從早期的鼠源性抗體已經過渡到現在的人源化抗體,從抗體類型來看,由于免疫球蛋白G天然結合位點多,對靶抗原親和力高,血液循環中半衰期較長目前廣泛應用于ADC的研發中。IgG有四種亞型,各亞型的結構和功能差異如下:
目前已上市的ADC藥物中,除輝瑞的Mylotarg和Besponsa采用IgG4抗體,其余均選擇IgG1作為抗體。IgG1和IgG3相比IgG2和IgG4對Fc受體的親和力更高,表明其可以介導更強的激活抗體依賴的細胞性效應及補體依賴的細胞性效應。IgG3半衰期短,易被清除,IgG2則會形成二聚體誘發聚集導致ADC失效,因而這兩種亞型應用較少。
1.2.3.連接子
連接子是抗體與載藥之間形成共價連接的部分,是靶向藥物治療中的關鍵元件,連接子的加入不應誘導聚集,并且需要確保可接受的PK特性,避免過早裂解導致載藥對正常細胞造成殺傷作用,但又要使ADC進入腫瘤細胞后有效釋放。因而,連接子是決定ADC藥物臨床療效和副作用的關鍵組分,連接子從性能上可分為可裂解連接子和不可裂解連接子。可裂解型的連接子利用體循環和腫瘤細胞之間的環境差異分解并釋放載藥,可進一步分為化學依賴性連接子和基于肽鍵的酶依賴性連接子。由于血液中存在蛋白酶抑制劑,酶依賴性連接子在體循環中通常是穩定的,當ADC到達病灶后,酶依賴性連接子被腫瘤細胞中過度表達的溶酶體蛋白酶降解,載藥被釋放并擴散到臨近細胞進一步增強對腫瘤的殺傷力,誘發所謂的“旁殺者效應”。因而,這類連接子被廣泛使用在已經批準上市的14款ADC藥物中,9款使用基于肽鍵的酶依賴性連接子,代表性藥物如維布妥昔單抗,polatuzumabvedotin,戈沙妥珠單抗,T-DXd等。
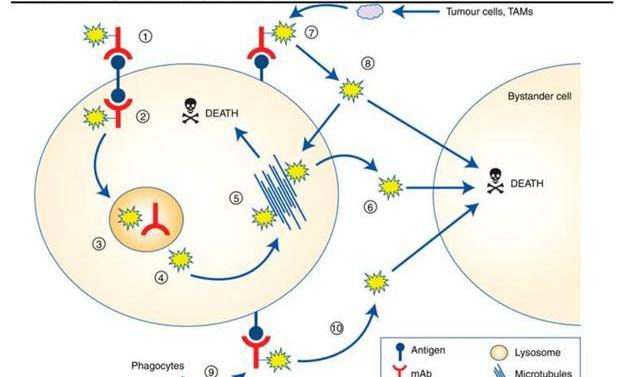
不可裂解連接子是通過細胞內溶酶體切割抗體和連接子的連接,其在血漿中更穩定,因而脫靶性更低,但這種切割方式常導致載藥上的帶電氨基酸保留從而影響其細胞通透性,阻止載藥擴散到周圍細胞,因而不會產生“旁殺者效應”。常見的不可裂解連接子如硫醚連接子、酰胺類連接子等,代表性藥物如:T-DM1,Belantamabmafodotin。
1.2.4.載藥
載藥是ADC內化到腫瘤細胞后發揮細胞性的化學分子,通常靜脈注射給藥只有大約2%的ADC可以到達腫瘤部位,所以一般要求載藥的性要足夠強,IC50值在0.01-0.1nM,還要具有足夠的水溶性及血清中的穩定性,具有與抗體共價結合的功能基團,作用靶點位于細胞內等。目前,常用的ADC載藥主要包括強效微管蛋白抑制劑、DNA損傷劑和免疫調節劑。
早期的ADC設計中使用傳統化療藥物,例如:甲氨蝶呤、多柔比星、長春新堿等,研究顯示這種ADC并不比它們的傳統模式更有效。抗體靶向給藥劑量中只有很小一部分能夠到達腫瘤組織,提示需要具有更強細胞性的載荷才能達到治療效果。因此,在后續的ADC研究中引入了性更強的化療藥物,例如:Auristatins、calicheamicins、美登素類化合物、喜樹堿衍生物等,這些藥物在亞納摩爾級濃度下就可顯示出細胞性。除此之外,越來越多的新型載藥如Toll樣受體激動劑和干擾素基因刺激劑激動劑被引入ADC的設計中,使得ADC的種類越來越豐富。
1.2.5.載藥-抗體比
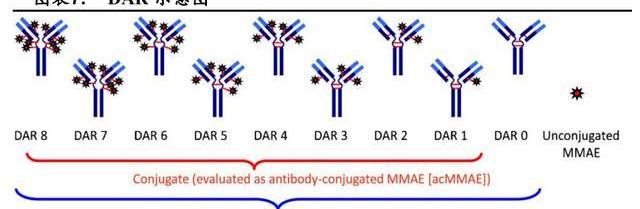
載藥-抗體比例,是指每個單抗上搭載的載藥的平均數量,這與ADC的藥理學活性有關,目前獲批ADC的DAR范圍為2-8。一般來說,體外試驗中,高DAR的ADC活性更高,但可能會更快地通過肝臟從血漿中清除。以BrentuximabVedotin為例,在小鼠模型中DAR為8的ADC血漿清除速度比DAR為2的快5倍,性雖然增加了但治療效果反而更差。臨床前研究顯示:更高的DAR之所以肝臟清除率更快與抗體-連接子復合物的疏水性增加有關,這可以通過引進親水性結構來避免。對于藥物連接子和DAR不影響血漿清除率的ADC來說,更高的DAR則意味著體內更高的抗腫瘤活性。
加密交易員:料比特幣在2023年底回升至3萬美元,2024年再創新高:金色財經報道,知名加密交易員Ben Armstrong在26日分享了他對于比特幣未來幾年的看法。在社交媒體上,他表示,到2023年底,比特幣可能回升至3萬美元左右。同時,他預測,到了2024年,比特幣價格可能會再創歷史新高。他強調,2024年比特幣價格會上漲的原因在于他相信比特幣在減半后會上漲。不過,他也預測,到了2025年,比特幣會重返熊市。[2022/12/27 22:11:05]
1.2.6.偶聯方式
偶聯方式決定了ADC的DAR和均一性,通常分為隨機偶聯和定點偶聯。*隨機偶聯是指不對抗體本身進行改造,直接利用其表面的賴氨酸殘基的烷基化或酰化作用或通過還原二硫鍵釋放半胱氨酸殘基與連接子相連,偶聯過程隨機進行,偶聯位置和載藥數目不確定,產生的ADC是DAR不一的混合物。這些混合物穩定性差,易發生聚集,動力學性質不一,導致非治療性副作用,治療窗窄。*定點偶聯技術指的是通過對抗體本身進行改造實現在抗體特定位點連接載藥,導致ADC的均一性大為提高,從而降低非治療性副作用,拓寬治療窗口,成為ADC開發的重要發展方向。
總的來說:ADC藥物發展至今共經歷了三代技術變革,在抗體、載藥、連接子等方面均有突破。第一代的ADC藥物以Gemtuzumabozogamicin為代表,抗體多采用鼠源或嵌合人源化抗體,連接子不穩定,載藥的性較低且是隨機偶聯因而有效性不高,副作用較大;第二代的ADC藥物以Brentuximabvedotin和ado-trastuzumabemtansine為代表,采用人源化抗體、性更高的載藥、抗體的靶向性也更好,但隨機偶聯造成的脫靶性仍不可忽視;第三代的ADC藥物以fam-trastuzumabderuxtecan為代表,完全人源化的抗體、高性載藥以及定點偶聯技術的使用使得療效更好,但高性載藥所帶來的可能副作用仍存在。
2.ADC全球研發現狀
2.1.ADC交易、融資熱度持續上升
ADC藥物市場空間增長潛力巨大。全球ADC藥物市場增長強勁,目前已獲批14款ADC藥物。根據醫藥魔方統計,2019年全球銷售額為28億美元,2021年已突破50億美元。鑒于目前已獲批的大多數ADC藥物是后線療法加之一些創新性ADC藥物獲批不久,市場還在逐漸培育中,預計全球的ADC藥物市場將維持高增長率。根據樂普生物招股說明書的披露,預計全球的ADC藥物市場2024年及2030年將分別達104億美元及207億美元,2019年至2024年的復合年增長率為30.6%,2024年至2030年的復合年增長率為12.0%;中國ADC的市場直至2020年才出現,由于ADC技術的不斷突破,研發管線的不斷擴容,針對的適應癥也不斷擴大,中國ADC治療市場高速增長,預計于2024年及2030年將分別達人民幣74億元及人民幣292億元的規模,2024年至2030年的復合年增長率為25.8%。
相比于傳統療法,ADC擁有無可比擬的優勢,激發了全球的開發熱情。傳統的腫瘤療法如抗體藥物和化療,均有其各自的局限性。抗體藥物的安全性和療效特征受到批次差異、背景信號干擾和副作用等問題的影響,而化療則表現出高脫靶性,由于不能有效區分健康細胞和腫瘤細胞而導致感染、脫發和惡心等風險的增加。相比之下,ADC綜合了抗體療法、化療和小分子抑制劑療法的主要優勢,具有獨特的靶向能力,并顯示出了更好的臨床試驗結果,為腫瘤患者提供了更好的治療選擇,表現出了很大的優勢。
為了進入該領域,ADC相關的BD交易無論是數量還是金額都直線上升。2020年吉利德以210億美元的高價收購了ADC公司Immunomedics,創下當年最高交易紀錄。盤點2021年我們可以看到第一三共成為最大的贏家,它的兩款產品DS-8201和DS-1062均達成了金額超60億美元的交易。榮昌生物將維迪西妥單抗的海外權益以26億美元的高價出售給Seagen證明了中國企業的研發實力。2022年2月,強生和禮來分別與ADC公司Mersana和ImmunoGen達成了金額超10億美元的合作,巨頭的入局讓該賽道更加火熱。
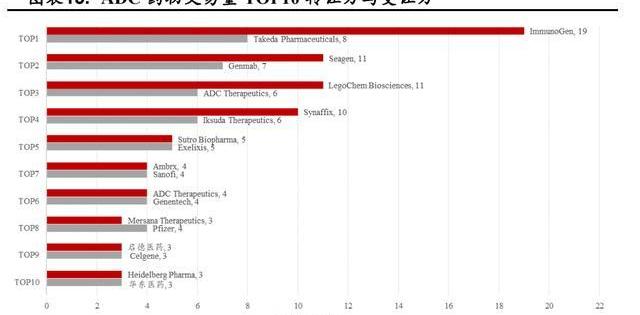
截至2022年4月17日,從ADC相關的交易我們可以看到ImmunoGen、Seagen、LegoChemBiosciences、Synaffix轉讓的次數最多,證明了它們在ADC領域卓越的研發實力,我國在該領域與國際先進水平尚有較大差距。
分析歷年ADC產品交易時所處的研發進度我們可以發現:絕大多數產品處于研發早期,臨床前占比76.25%,臨床I期占比10%,臨床I/II期占比4.4%,臨床II期占比2.5%。
盤點過去五年ADC相關的交易我們可以看到:參與ADC交易的中國企業熱情非常之高,連續5年成為最大的交易受讓方,2021年更是達到了14項之多,而參與交易的這些ADC產品絕大多數針對的適應癥均是腫瘤。
從一級市場的融資來看,醫藥魔方數據顯示:2021年國內外ADC藥物領域共披露了40多起融資事件,六成以上融資發生在國內,多禧生物的C輪融資達10億元人民幣拔的國內頭籌。AOC、ISAC、VDC等ADC藥物的衍生物也逐漸進入人們的視野。
2.2.全球ADC藥物研發概況
根據醫藥魔方的數據:全球ADC藥物在研管線靶點雖呈現出多樣化發展的趨勢,但目前主要還是集中在HER2、EGFR、TROP-2、Claudin18.2少數幾個熱門靶點,其他靶點開發的空間還很大。
從布局的適應癥來看,集中度非常高。95.17%的管線布局的適應癥均是腫瘤,其次是自身免疫性疾病、細菌感染、濕性年齡相關性黃斑變性等。
2.3.中國ADC藥物研發概況
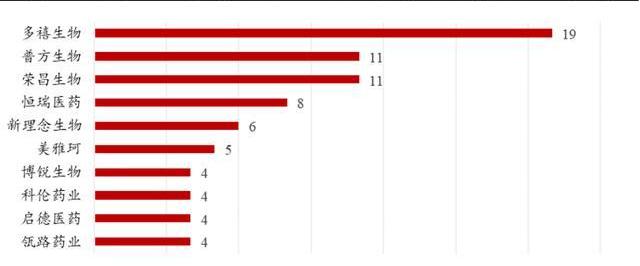
截至2022年4月,根據醫藥魔方數據庫的披露:多禧生物、普方生物、榮昌生物、恒瑞醫藥是國內布局ADC管線最多的四家企業。
與全球的研發趨勢類似,國內ADC在研藥物靶點也是集中在HER2、EGFR、TROP-2、Claudin18.2、c-Met、PSMA、CD19這些熱門靶點。
從布局的適應癥來看,集中度同樣也是非常高。95.2%的管線布局的適應癥是腫瘤,其次是自身免疫性疾病、細菌感染、濕性年齡相關性黃斑變性等。而在布局的主要腫瘤類型中,又以乳腺癌、非小細胞肺癌、卵巢癌、胃癌、結直腸癌等實體瘤為主。
從研發進度來看,同樣絕大多數的研發項目均處于早期開發階段。其中無申報占比61.82%,臨床前占比18.87%,臨床I期占比8.24%,臨床I/II期占比1.08%,臨床II期占比1.95%。
3.全球主要代表性ADC藥物
3.1.輝瑞:ADC領域的先驅,推出全球首個ADC藥物Mylotarg
Mylotarg原研公司為輝瑞,由靶向CD33的單抗與抗腫瘤抗生素卡奇霉素偶聯而成,該藥是全球第一個上市的ADC藥物,也是獲得FDA加速批準的所有新藥中第一個退市的藥物,同時又是第一個退市后再次上市的ADC藥物。目前已獲FDA批準的適應癥包括:初診CD33陽性的成人和大于1個月的兒童急性骨髓性白血病;復發或難治性的CD33陽性成人和大于2歲的兒童急性骨髓性白血病。
ZT創新板即將上線DED:據官方公告,ZT創新板即將上線DED,已經開啟DED充值,并于6月10日16:00開啟DED/USDT、DED/ZTB交易對。
DED是一個基于ZSC開發的高效兌換協議與社區自治生態。DED為用戶提供低滑點低手續費高效的穩定幣兌換,同時增強了銷毀與賦能機制提供自組社區自治生態讓用戶自動接入其它DeFi流動性收益。
ZT數字資產交易平臺是一家全球性的數字資產交易服務商,致力于為全球用戶打造創新型熱門數字資產首發地。[2021/6/5 23:14:46]
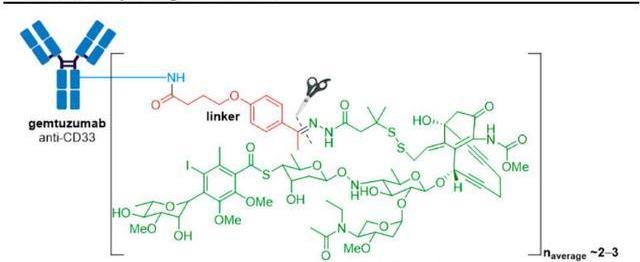
FDA于2000年批準Mylotarg上市用于“60歲以上且不適合細胞化療的首次復發型CD33陽性AML患者的治療”,但上市后的驗證性Ⅲ期研究發現該藥有嚴重的致死性肝損傷,聯合用藥組的死亡率高于單獨使用化療組,而且未表現出明顯的生存獲益。輝瑞于2010年6月主動將Mylotarg撤市,對“給藥方案”進行了優化:一方面,通過降低單次給藥劑量從而降低副作用,此外還在給藥方案中引入“誘導周期”和“鞏固周期”以確保療效。
得益于給藥方案的調整,Mylotarg的臨床療效得到了提高:對于AML一線治療患者,Mylotarg聯合化療組與只接受化療組的頭對頭III期臨床試驗數據顯示:Mylotarg組患者的中位無事件生存期從9.5個月延長到了17.3個月,事件風險降低了44%。
對于經歷過一次復發的AML患者,MyloFrance-1試驗的數據顯示:Mylotarg單藥治療可以實現26%的患者完全緩解率,所有患者的中位緩解時間達11.6個月。Mylotarg的波折遭遇凸顯了“給藥方案”的重要性,目前在ADC的設計中一個趨勢就是載藥的設計性越來越強,但高性是把雙刃劍,需要吸取Mylotarg的教訓。總之,Mylotarg在經歷撤市風波后重振雄風,一鼓作氣更是將AML適應癥由原來的后線用藥推到了一線用藥,給后來者積累了寶貴的經驗。
3.2.羅氏:T-DM1鞏固其在乳腺癌領域的霸主地位
Kadcyla是羅氏研發的一款HER2ADC藥物,由靶向HER2的曲妥珠單抗與抑制微管聚集的化療藥物美坦新通過不可裂解的硫醚連接子MCC連接而成,DAR=3.5,不存在“旁殺者效應”。
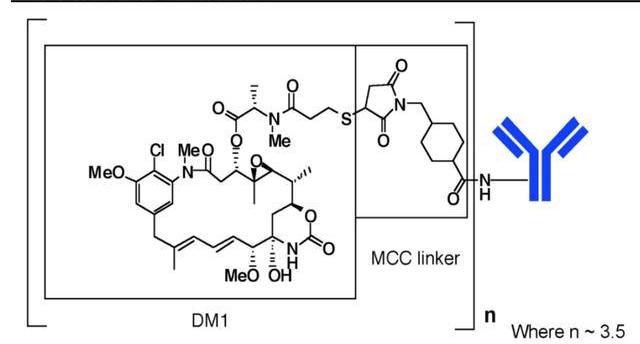
T-DM1是全球第一個獲批用于實體瘤的ADC,已獲FDA批準上市的適應癥包括“HER2陽性早期乳腺癌的輔助治療”,以及“HER2陽性轉移性乳腺癌的二線治療”,但它在胃癌和NSCLC上并未達到像乳腺癌中的預期效果,T-DM1于2020年1月成為中國大陸第一個獲批上市的ADC藥物。
3.2.1.針對HER2陽性早期乳腺癌的輔助治療
對于經紫杉烷和曲妥珠單抗治療后仍有殘留浸潤性腫瘤細胞的HER2陽性乳腺癌患者,T-DM1與曲妥珠單抗頭對頭的試驗結果顯示:T-DM1組的3年無浸潤性腫瘤復發生存率顯著高于單獨使用曲妥珠單抗治療的對照組,將HER2陽性早期乳腺癌患者復風險降低了50%。
3.2.2.針對HER2陽性局部晚期或轉移性乳腺癌二線治療
經曲妥珠單抗或紫杉烷類單藥或兩者聯合治療后仍有進展的局部晚期或轉移性HER2陽性乳腺癌患者,T-DM1單藥與化療組合“拉帕替尼+卡培他濱”的頭對頭III期臨床試驗結果顯示:兩者的中位總生存期30.9個月VS25.1個月;中位無進展生存期9.6個月VS6.4個月;客觀緩解率43.6%VS30.8%;中位持續緩解時間12.6個月VS6.5個月,可以說T-DM1完勝化療組合療法。基于該試驗FDA批準了T-DM1二線治療HER2陽性轉移性乳腺癌,此后T-DM1成為該適應癥的標準療法,目前是全球最為暢銷的ADC藥物,2021年度全球銷售額達21.78億美元。T-DM1連同曲妥珠單抗和帕妥珠單抗完成了HER2陽性乳腺癌從“術前的新輔助治療”、“術后的輔助治療”到“晚期轉移性的一線及二線治療”全療程覆蓋,奠定了羅氏在乳腺癌領域的霸主地位。
3.3.Seagen:Adcetris樹立了CD30陽性淋巴瘤治療的新標桿
Adcetris由靶向CD30的人鼠嵌合單抗Brentuximab、可裂解的瓜氨酸-纈氨酸二肽連接子和微管抑制劑MMAE偶聯而成,DAR為4,分子量為153kDa。
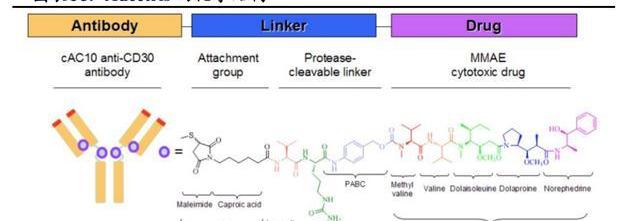
作為血液瘤領域商業化最為成功的ADC藥物。目前,Adcetris在全球已獲批六項適應癥,主要集中在系統性間變性大細胞淋巴瘤、外周T細胞淋巴瘤、經典霍奇金淋巴瘤三個癌種,圍繞這三個癌種不斷深耕,成功從后線推移到一線,樹立了CD30淋巴瘤一線治療的標桿。

3.3.1.針對CD30陽性經典霍奇金淋巴瘤的一線治療
在Adcetris之前,CD30陽性經典霍奇金淋巴瘤的標準一線治療是化療組合ABVD。Adcetris之前聯合AVD與化療組合ABVD一線治療晚期經典霍奇金淋巴瘤的頭對頭隨機、開放、多中心3期研究ECHELON-1結果顯示:中位隨訪24.6個月,主要終點分析顯示,Adcetris+AVD組和ABVD組患者獨立評審委員會評估的2年修訂版PFS率分別為82.1%和77.2%,前者降低死亡或疾病進展風險23%,研究者評估的2年修訂版PFS率分別為81.0%和74.4%,前者降低死亡或疾病進展風險28%。次要終點分析顯示,Adcetris+AVD組VSABVD組,完全緩解率分別為73%vs70%,3%客觀緩解率分別為86%vs83%,3.2%。安全性分析顯示,Adcetris+AVD組的安全性與單藥已知的安全性總體上一致。基于該試驗FDA批準了Adcetris一線治療經典霍奇金淋巴瘤,終結了該領域40多年沒有新的治療方案的歷史。
3.3.2.針對CD30陽性外周T細胞淋巴瘤的一線治療
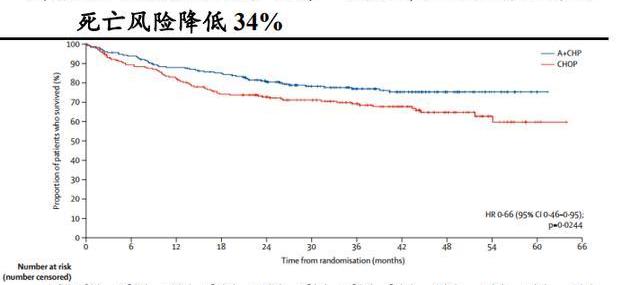
在外周T細胞淋巴瘤一線治療方面,Adcetris聯合化療方案CHP與公認的治療PTCL的一線標準治療方案CHOP的頭對頭隨機、雙盲、國際多中心、III期研究試驗結果顯示:中位隨訪36.2個月,與標準一線化療CHOP相比,Adcetris+CHP治療組可使患者的中位無進展生存期由20.8個月延長到48.2個月,疾病進展風險降低29%,3年無進展生存期由44.4%提高到57.1%,死亡風險降低34%,Adcetris聯合化療方案CHP樹立了PTCL治療的新標桿。
3.4.阿斯利康/第一三共:DS-8201力壓群雄
Euhertu由人源化HER2單克隆抗體曲妥珠單抗通過可裂解的多肽連接子偶聯拓撲異構酶I抑制劑喜樹堿衍生物構建而成,DAR為8。曲妥珠單抗與腫瘤細胞表面的靶點HER2結合被其介導的內吞作用進入腫瘤細胞,進入融媒體后多肽連接子被裂解,釋放出載藥DXd抑制拓撲異構酶I的活性,進而引發DNA損傷和細胞凋亡。
“數字經濟之父”Don Tapscott:最快理解價值互聯網的國家將在21世紀主導創新:火幣于10月27日~10月28日正式舉辦“無限未來——2020年區塊鏈大航海時代”行業峰會暨火幣集團七周年線上峰會。在本次峰會“鴻蒙初開,區塊鏈世界的崛起和先行者的眺望”主題板塊中,火幣集團創始人李林與新經濟學家、“數字經濟之父” Don Tapscott展開對話。
Don Tapscott在對話中表示,全球排名前十五位的價值互聯網中心里,有五個出現在中國。全球價值互聯網的中心有紐約、多倫多、倫敦,在首爾也有很多有趣的事情發生,但是在中國,上海、北京、杭州、深圳以及海南省都有了非常多的舉措,這是非常積極的表現,因為最快理解價值互聯網的國家將在21世紀主導創新。另外一方面是央行數字貨幣,中國目前在全球處于領先地位,這都是非常具有突破性的事。因為中國的DC/EP發展迅速,可以擴展到整個亞洲,通過一帶一路達到非洲。[2020/10/27]
3.4.1.針對HER2陽性乳腺癌后線治療
開放標簽、單臂、多中心的II期臨床研究DESTINY-Breast01研究顯示:184例HER2陽性乳腺癌患者已經使用了兩種或兩種以上治療方案,接受DS-82015.4mg/kg的治療后,中位隨訪11.1個月,客觀緩解率達60.9%;其中4.3%的患者達到完全緩解率;56%的患者達到局部緩解,中位持續緩解時間為14.8個月,中位無進展生存期為16.4個月。這些患者先前均接受過T-DM1治療,中位治療線數為6,幾乎窮盡HER2陽性乳腺癌治療手段但仍取得了亮眼的臨床數據,顯示了其巨大的臨床價值。安全性方面間質性肺病/肺炎的發生概率是9%,其中2.6%是致命性的,ILD和胚胎性被FDA列入黑框警告。基于該實驗2019年12月FDA批準了DS-8201用于治療既往已經接受2種及以上HER2靶向療法的成人不可手術切除或轉移性HER2陽性乳腺癌患者。
3.4.2.針對HER2陽性轉移性胃或胃食管交界處腺癌后線療法
開放標簽、多中心、隨機DESTINY-Gastric01研究顯示:對于既往至少接受過二線治療的HER2陽性胃或胃食管交界處腺癌,DS-8201組相比于對照化療組,客觀緩解率,疾病控制率85.7%vs62.5%;中位總生存期12.5vs8.9個月,死亡風險降低41%,12個月OS率:52.2%vs29.7%;中位無進展生存期5.6vs3.5個月,疾病進展風險降低53%。16例患者發生T-DXd相關的間質性肺病,而化療組未發生。
3.4.3.針對HER2陽性轉移性乳腺癌2線療法
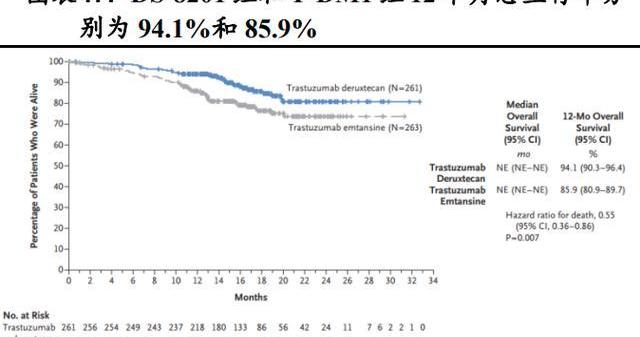
隨機、開放標簽、DS-8201和T-DM1的頭對頭III期臨床試驗DESTINY-Breast03研究旨在評估二者在既往接受過曲妥珠單抗和紫杉烷治療的HER2陽性轉移性乳腺癌患者中的療效和安全性。研究結果顯示,在524例隨機分組的患者中,DS-8201組和T-DM1組12個月無進展生存率分別為75.8%和34.1%。12個月時,DS-8201組和T-DM1組總生存率分別為94.1%和85.9%。DS-8201組確認的客觀緩解率為79.7%,而T-DM1為34.2%。
DS-8201確認的客觀緩解率為79.7%,T-DM1為34.2%。對DS-8201有反應的患者中,16.1%達到完全緩解,63.6%達到局部緩解,16.9%疾病穩定,1.1%出現疾病進展。調查組和對照組的疾病控制率分別為96.6%和76.8%。
基于該試驗2022年5月FDA批準DS-8201用于治療先前接受過抗HER2治療方案的不可切除或轉移性HER2陽性乳腺癌成年患者。可以說DS-8201完全瓦解了T-DM1作為乳腺癌二線治療標準療法的地位,2022版的NCCN指南針對HER2陽性、復發性不可切除或IV期疾病的全身治療二線方案的推薦DS-8201的級別已經高于T-DM1。2022年全國乳腺癌大會暨中國臨床腫瘤學會乳腺癌年會新增DS-8201作為曲妥珠單抗治療乳腺癌失敗患者的治療的II級推薦,最高的1A證據等級。回溯一下我們可以看到,DS-8201相比于T-DM1的DAR更高,載藥不僅性更強,而且均一性也更好,這成為它勝出的重要原因。
3.4.4.針對HER2突變的非小細胞肺癌后線療法
開放標簽、多中心的II期臨床試驗研究顯示:對于標準治療無效的轉移性HER2突變的NSCLC患者,截至2021年5月,中位隨訪時間為13.1個月,接受Enhertu治療的91位患者,獨立審查委員會確認的客觀緩解率達到55%,疾病控制率為92%,中位緩解持續時間為9.3個月,中位無進展生存期為8.2個月,中位總生存期為17.8個月。DS-8201對晚期HER2突變的NSCLC患者顯示出持久的抗腫瘤活性,安全性與先前研究的基本一致。49%的患者發生3級或更高級別的藥物相關不良事件,最常見的事件是中性粒細胞減少癥。26%的患者發生藥物相關間質性肺病,并導致2名患者死亡。
DS-8201目前已獲得FDA突破性療法認定,用于治療攜帶HER2突變且在鉑類藥物治療期間或治療后發生疾病進展的轉移性NSCLC患者。此外,DS-8201一方面在探索與抗PD-1抗體等免疫療法聯用,另一方面還在不斷擴大適應癥。目前在結直腸癌、三陰性乳腺癌、膀胱癌等癌種中進行臨床試驗,強悍的臨床療效加上不斷擴展的適應癥使得DS-8201一時間風頭無倆,這就是為什么NatureReviewsDrugDiscovery預測該藥將在2026年全球銷售額達到62億美元,占全球最早上市的10款ADC藥物近4成份額的底氣所在。在中國市場,2020年12月DS-8201獲得CDE授予的突破性療法資格,單藥用于既往接受過一種或一種以上治療方案的HER2陽性局部晚期或轉移性胃或食管胃結合部腺癌成人患者的治療。今年3月21日,DS-8201在國內的上市申請獲得NMPA受理。
3.5.吉利德:Trodelvy全球首個獲批上市的TROP-2的ADC
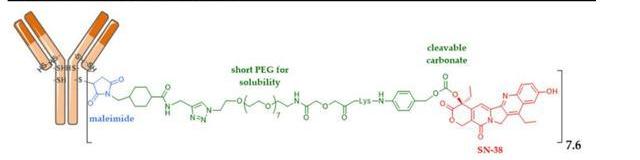
Trodelvy的原研公司是被吉利德以210億美元收購的Immunomedics,該藥由靶向TROP-2抗原的人源化IgG1抗體通過可裂解的連接子與載藥拓撲異構酶I抑制劑SN38偶聯而成,目前是全球唯一一款上市的靶向TROP-2的ADC藥物。
3.5.1.針對三陰性乳腺癌后線治療
全球性、開放標簽、隨機III期臨床試驗ASCENT比較了Trodelvy與化療單藥治療復發或難治性轉移性三陰性乳腺癌患者的療效和安全性。Trodelvy組的中位無進展生存期相比于化療組4.8月VS1.7月,疾病進展風險降低了57%,中位總生存期則是11.8月VS6.9月,死亡進展風險降低了49%,客觀緩解率31%VS4%。
基于ASCENT試驗的結果Trodelvy于2020年4月被FDA批準用于治療既往已接受至少2種療法的轉移性三陰性乳腺癌成人患者,它也是首款獲得FDA批準治療轉移性三陰性乳腺患者的靶向TROP-2的抗體偶聯藥物,給TNBC患者提供了新的治療選擇。
動態 | 北京金融科技創新監管試點聚焦區塊鏈等前沿技術在金融領域的應用:北京金融科技創新監管試點應用首次公示亮相,2020年1月14日向社會公示6個創新應用,涉及國有商業銀行、全國性股份制商業銀行、大型城市商業銀行、清算組織、支付機構、科技公司等多家機構,主要聚焦物聯網、大數據、人工智能、區塊鏈、API等前沿技術在金融領域的應用,涵蓋數字金融等多個應用場景,旨在紓解小微企業融資難融資貴問題、提升金融便民服務水平、拓展金融服務渠道等。試點項目代表了目前我國金融科技發展的主流方向和先進成果,具有技術先進、場景普適、示范性強等特點。(財聯社)[2020/1/14]
3.5.2.針對尿路上皮癌的后線治療
多隊列、開放標簽、II期注冊研究IMMU-132-06結果顯示:Trodelvy針對接受過含鉑化療聯合PD-1抑制劑或PD-L1抑制劑的局部晚期或轉移性尿路上皮癌患者,中位隨訪9.1個月時,客觀緩解率為27%,中位持續緩解時間為7.2個月,中位無進展生存期為5.4個月,中位總生存期為10.9個月。
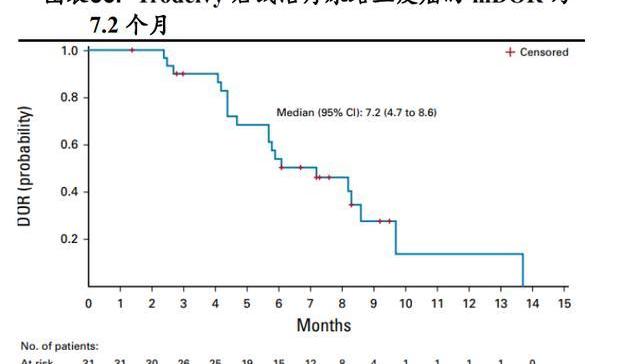
基于TROPHY-U-01試驗,2021年4月,Trodelvy又被FDA加速批準用于治療含鉑化療聯合PD-1抑制劑或PD-L1抑制劑的局部晚期或轉移性尿路上皮癌成人患者。2022年3月7日吉利德公布了Trodelvy治療先前已接受過內分泌治療、CDK4/6抑制劑、2至4線化療方案的HR+/HER2-轉移性乳腺癌患者的臨床3期TROPiCS-02研究結果:該研究達到了主要終點,與化療組相比,Trodelvy治療組無進展生存期有統計學意義的顯著改善。主要終點結果與臨床1/2期IMMU-132-01研究中觀察到的結果一致,安全性結果也與之前的研究一致,詳細的臨床數據將在后續的學術會議上公布。Trodelvy所靶向的TROP-2抗原在多種腫瘤細胞中均大量表達,理論上該藥對這些實體腫瘤均有治療潛力。目前Trodelvy或單藥或與抗PD-1單抗等藥物聯用針對轉移性非小細胞肺癌等實體瘤開展了多項臨床試驗探索,未來具有較大想象空間。
4.國內重要代表性ADC藥物
4.1.榮昌生物:RC48國內ADC藥物的先行者
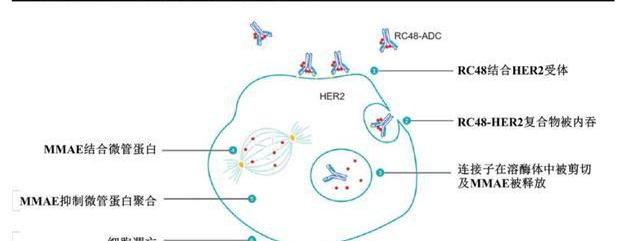
維迪西妥單抗是一種新型的靶向HER2的抗體偶聯藥物,由重組的人源化HER2IgG1單克隆抗體Disitamab通過可裂解的連接子MC-Val-Cit-PAB與微管抑制劑單甲基澳瑞他汀E偶聯而成,DAR=4。
RC48的抗體部分結合至腫瘤細胞表面HER2的胞外結構域后,ADC復合物經細胞內吞并轉運到溶酶體,連接子經酶切后釋放出微管抑制劑MMAE,破壞細胞內微管網絡,導致有絲分裂細胞周期停止和細胞凋亡。此外,體外研究顯示RC48可抑制HER2受體信號,并具有抗體依賴細胞介導的細胞性作用。
4.1.1.針對HER2過表達胃癌的后線治療
開放性、多中心、單臂II期的臨床試驗C008研究招募的127名至少接受過2個系統化療的HER2過表達局部晚期或轉移性胃癌)患者,每兩周接受一次2.5mg/kg的RC48治療,直至發生疾病進展、不可耐受性、死亡或患者撤回知情同意書。公司分別于2019年12月17日和2020年6月22日開展了階段性臨床數據分析,并于2021年1月25日完成了末例受試者入組后12個月的生存隨訪分析。截至2020年6月22日的階段性臨床數據分析,獨立審查委員會評估確認127名患者的客觀緩解率為24.4%,中位無進展生存期為4.1個月,中位總生存期為7.6個月。安全性方面,在127名患者中,最常報告的TRAE為白細胞計數降低,脫發,中性粒細胞計數降低及乏力。
基于該臨床試驗,RC48于2021年6月獲國家藥監局附條件批準上市,用于接受過至少兩種系統化療的HER2過表達局部晚期或轉移性胃癌患者的治療。此外,2018年7月FDA授予了RC48用于治療胃癌的孤兒藥資格認定,可在美國享有上市批準后RC48對胃癌的七年市場獨占期。公司2020年9月向FDA提交了RC48用于治療胃癌的II期臨床試驗的IND,并于2020年11月獲得FDA的快速通道資格認定,公司將擇機啟動該實驗。此外,公司未來將擇機向歐洲EMA提交RC48治療胃癌的臨床試驗申請。
4.1.2.針對HER2過表達尿路上皮癌后線療法
RC48單藥治療HER2過表達的尿路上皮癌UC的注冊性II期臨床試驗募集了64名HER2過表達局部晚期轉移或不可切除的尿路上皮癌患者的中位年齡為62.5歲,89.1%存在內臟轉移,85.9%曾接受過至少兩種化療,29.7%曾接受過免疫檢查點抑制劑治療。這些患者每兩周接受一次2mg/kg劑量的RC48單藥治療,直至發生疾病進展、不可耐受性、主動退出、死亡或申辦方終止研究。結果顯示:總客觀緩解率為50.0%,疾病控制率為76.6%。中位無進展生存期為5.1個月,中位總生存期為14.2個月。
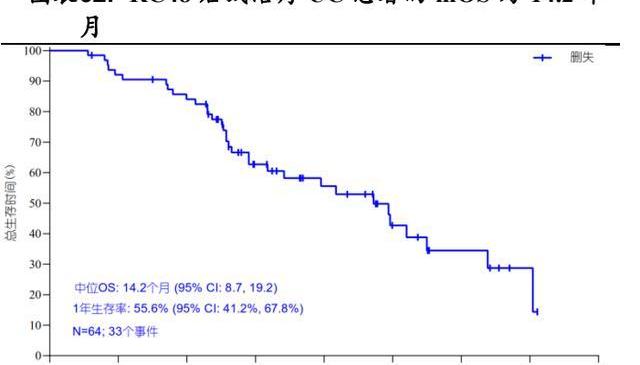
基于該臨床試驗RC48于2022年1月獲得國家藥監局附條件批準上市,用于接受過至少兩種系統化療的HER2過表達局部晚期或轉移性尿路上皮癌患者的治療。與此同時,RC48也于2020年4月獲FDA批準在美國開展治療治療尿路上皮癌的II期臨床試驗,并在2020年7月和2020年9月獲得美國FDA授予治療尿路上皮癌的快速通道資格與突破性療法認定。
4.1.3.針對不限HER2表達狀態的尿路上皮癌
公司開展的RC48聯合特瑞普利單抗治療局部晚期或轉移性尿路上皮癌的Ib/II期研究者發起的研究入組了19名不限制HER2表達狀態、無法耐受或拒絕一線含鉑化療的局部晚期轉移性或不可切除的尿路上皮癌患者。截至2021年4月初步結果顯示,在19例入組患者中,共17例患者完成了至少1次療效評價,其中16例患者達到緩解,總客觀緩解率為94.1%,包括3例完全緩解、13例局部緩解。絕大多數患者在第一次療效評價時出現緩解。對于不同的既往化療線數、HER2表達狀態,客觀緩解率較為一致,其中一線治療患者的客觀緩解率達到100%,HER2表達患者的客觀緩解率達到100%。
4.1.4.針對HER2陽性乳腺癌
開放標簽、劑量遞增的I期臨床試驗,共招募及治療了70名HER2陽性乳腺癌患者。主要試驗終點為評估RC48的最大耐受劑量、安全性和明確II期臨床試驗的推薦劑量。截至2020年12月31日,結果顯示:接受1.5mg/kg、2.0mg/kg及2.5mg/kg劑量的患者亞組,總客觀緩解率分別為22.2%、42.9%及40.0%,中位無進展生存期分別為4.0個月、5.7個月及6.3個月。
4.1.5.針對HER2低表達乳腺癌
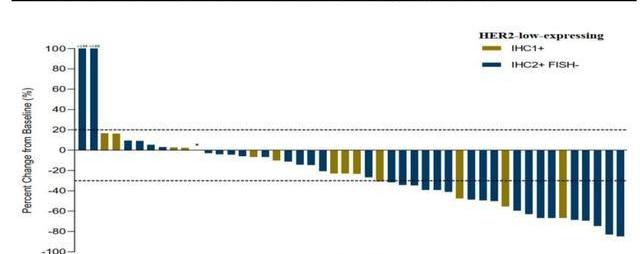
公司開展的開放標簽設計的Ib期臨床試驗,招募了48名HER2低表達乳腺癌患者,均采用一個劑量治療。結果顯示,總客觀緩解率和中位無進展生存期分別為39.6%和5.7個月,其中35名IHC2+/FISH-患者的客觀緩解率和中位無進展生存期分別為42.9%和6.6個月,13名IHC1+患者的ORR和mPFS分別為30.8%和5.5個月。RC48表現出了對HER2低表達乳腺癌的良好的治療潛力,有望填補該巨大的治療市場的空白。
動態 | 莆田市舉行木材產業區塊鏈創新應用會議:12月12日,木材產業區塊鏈創新應用暨公共服務平臺采木網上線發布會在福建省莆田市秀嶼區舉行。此次活動主要圍繞“產業+互聯網+區塊鏈”,探討木材傳統產業的升級轉型之路,同時宣布采木網木材公共服務平臺上線發布。[2019/12/12]
除HER2表達胃癌、尿路上皮癌、乳腺癌之外,榮昌生物還在積極開展RC48用于治療HER2表達膽道癌、非小細胞肺癌等多種實體瘤的臨床研究。
4.2.浙江醫藥:ARX788有望挑戰DS-8201
浙江醫藥的ARX788是一款HER2-ADC藥物,于2013年6月從美國AmbrxBiopharma公司引進。ARX788的抗體部分曲妥珠單抗的重鏈有對乙酰苯丙氨酸121和對乙酰苯丙氨酸114兩個插入的非天然氨基酸,pAF上的酮官能團與載藥微管蛋白抑制劑AS269的羥胺基團特異性結合形成肟鍵,從而產生均質的ADC藥物,pAF-肟鍵極其穩定,不可切割,體內代謝產物僅有pAF-AS269,而無游離素AS269,該代謝物可以被HER2陽性細胞高效內吞和釋放,從而極大提高了有效性與安全性。
AmbrxBiopharma公司的非天然氨基酸定點偶聯技術制備的ADC藥物90%以上DAR為2,其余則是DAR1,實現了ADC藥物非常高的均一性水平。臨床前研究顯示:與傳統半胱氨酸偶聯產生的DAR為4.5的ADC相比,DAR為2的ARX788的抗腫瘤活性更高。
4.2.1.針對HER2陽性晚期或轉移性乳腺癌后線治療
ARX788在國內進行的針對HER2陽性晚期或轉移性乳腺癌患者的臨床1期劑量爬坡研究ACE-Breast-01顯示,截止到2021年12月14日,ARX788在1.5mg/kg組中已確認的客觀緩解率為66%,疾病控制率為100%,在1.3mg/kg組中已確認的客觀緩解率為50%,疾病控制率為88%。瀑布圖顯示1.5mg/kgQ3W組有3名患者,1.3mg/kgQ3W組和1.3mg/kgQ4W組各有1名患者病變100%減少,證明ARX788具有快速、深入、持久的治療腫瘤的潛力。目前針對該適應癥正在國內開展II/III期臨床研究。基于良好的臨床數據,2021年5月國家藥監局授予ARX788二線治療HER2陽性轉移性乳腺癌的突破性療法認定。
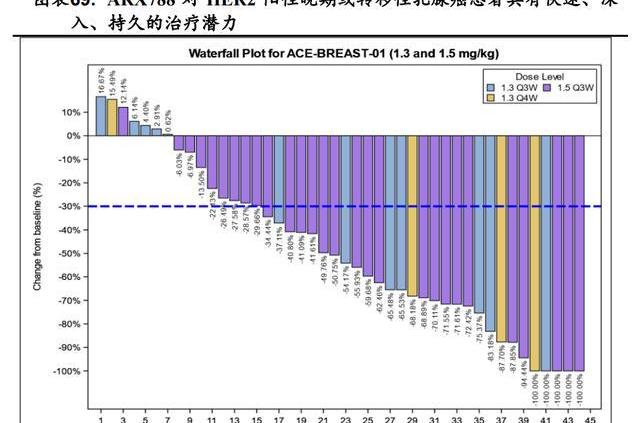
4.2.2.針對HER2陽性晚期胃癌二線療法
ARX788針對先前曲妥珠單抗的治療失敗的HER2陽性晚期胃癌患者的I期劑量擴增試驗研究顯示,截至2021年4月7日ARX788在1.5mg/kg組中已確認的客觀緩解率為46%,疾病控制率為46%,在1.3mg/kg組中已確認的客觀緩解率為43%,疾病控制率為57%。尚未觀察到劑量限制性性,也未達到最大耐受劑量,目前針對該適應癥正在國內開展II/III期臨床研究。
4.2.3.針對泛癌種
在美國和澳大利亞進行的一項ARX788針對HER2陽性實體瘤的I期劑量遞增試驗研究結果顯示,截止到2021年4月8日ARX788在1.5mg/kg組中已確認的客觀緩解率為67%,疾病控制率為100%,在1.3mg/kg組客觀緩解率未獲確認,但疾病控制率為100%。而且發現對于既往接受過T-DM1和DS-8201治療失敗的患者,ARX788仍能帶來臨床緩解。
4.3.科倫藥業:A166兼顧有效性和安全性的第三代ADC
A166是第三代靶向HER2的ADC,通過蛋白酶可裂解的連接子將曲妥珠單抗與新型載藥微管蛋白的抑制劑Duo-5定點偶聯。
4.3.1.針對HER2陽性乳腺癌后線治療
A166單藥治療經過多線治療的HER2陽性乳腺癌患者的I期劑量擴展研究共募集了58例HER2陽性乳腺癌患者,這些患者接受抗HER2治療線數為4,所有患者均接受過曲妥珠單抗±帕妥珠單抗治療,94.8%的患者接受過靶向HER2的TKI治療,20.7%的患者接受過HER2-ADC治療。試驗結果顯示,截至2021年12月10日,有效性方面:4.8mg/kg組和6.0mg/kg組,客觀緩解率分別73.91%和68.57%;中位無進展生存期分別為12.30月和9.40月。4.8mg/kg組有1例確認完全緩解的患者維持了超過7個月。在數據截止時間,仍有24例患者在繼續接受A166治療。安全性方面:發生≥3級治療相關不良事件為角膜上皮病變,視力模糊和潰瘍性角膜炎。整體不良反應可控,發生眼部不良事件的患者經用藥調整和對癥治療后,均可恢復。相比于同靶點已上市的HER-2ADC藥物,A166在安全性方面具有明確的優勢。為更好地平衡療效和安全性,A166在II期臨床研究的推薦劑量為4.8mg/kg。截至目前,A166首發適應癥HER2+乳腺癌關鍵II期多中心注冊臨床研究已完成入組,正在進行Pre-NDA的準備工作。Ib期拓展試驗包括NSCLC、結直腸癌和胃癌,正快速推進入組。
5.ADC藥物當前面臨的挑戰
ADC作為國內繼以抗PD-1單抗為代表的第一波創新藥之后技術成熟度最高的藥物發展方向,激發了各大藥企的熱情,成為兵家必爭之地。但藥物的研發要實現臨床有效性和安全性的統一,不能顧此失彼,Mylotarg從上市到退市再到重新上市的歷程充分說明了安全性在藥物研發中的重要性。各大藥企分別從ADC的各個組成要素切入,以求得到具有高臨床價值的ADC產品,但ADC藥物作為一個非常復雜的實體,并非幾個要素簡單組合一下就對患者具有臨床獲益,即使現在最新一代ADC藥物中采用的定點偶聯技術也不能保證能研發出療效良好的產品,代表性的如基因泰克研發的vadastuximabtalirine、AstraZeneca/MedImmune開發的MEDI4276均因安全性問題而折戟沉沙。由此可見,ADC的開發當前仍面臨不少挑戰。
5.1.復雜的藥代動力學特征
ADC給藥后,主要以結構完整的ADC、裸抗體和游離的載藥三種形式存在于體循環中,隨著ADC識別靶抗原、內化、去偶聯這三種存在形式處于動態變化中。典型的ADC藥代動力學特征是結構完整的ADC和裸抗體的濃度隨著ADC的內化和抗體的清除而不斷降低。影響抗體清除的因素包括單核吞噬細胞系統和Fc受體介導的再循環。通過與內吞液泡中的ADC結合,FcRn將ADC輸出到細胞外區室進行重復利用。因此,包括結構完整的ADC和裸抗體在內的抗體通常比傳統小分子藥物半衰期更長。至于游離的載藥主要在肝臟代謝,通過尿液或糞便排出體外,這個過程可能會受到藥物相互作用和肝腎功能損害的影響。以上所有因素再加上患者的個體差異性導致難以建立PK和PD模型來描述ADC的臨床特征并輔助于新型ADC的設計。
5.2.難以避免的副作用
“脫靶、脫腫瘤”相關不利事件似乎主導了大多數現有ADC的性特征。對現有數據的薈萃分析表明,不同的載藥小分子具有明顯的性特征,而且與靶抗原無關。比如MMAE與貧血、中性粒細胞減少、周圍神經病變相關,DM1與血小板減少和肝性相關,MMAF和DM4與眼部性相關。目前已經批準上市的14種ADC中,最常見的大于等于3級的嚴重副作用是血液性,包括中性粒細胞減少、血小板減少、白細胞減少和貧血。血液性、肝性和胃腸道反應等脫靶性可能與載藥過早釋放到血液循環、非腫瘤組織或腫瘤微環境中以及載藥對健康組織的后續影響有關,這類副作用與常規化療藥物影響快速增殖的健康細胞一致。
ADC的抗體部分誘導的免疫反應可能會引起繼發性損傷,從而導致腎性。
近來在HER2ADC的研究中發現ADC藥物會引起潛在的肺性作用,這個現象應引起注意。在T-DM1和DS-8201的臨床研究中有被報道的與ILD相關的幾例死亡病例,但ILD的發病機制仍不清楚。肺中的血流量豐富ADC停留的時間最長,這樣會造成ADC的不良攝取以及血液中的游離載藥會誘發肺病如ILD。
5.3.ADC的聚集
作為ADC的重要組成單元,抗體在ADC的整個全生命周期都有發生聚集的可能性,抗體一旦聚集不僅會造成產品損失,還會降低ADC與靶抗原的結合能力。外界的物理、化學等多種因素如高溫、低pH都會導致ADC空間結構發生變化,引起蛋白質聚集。因為暴露在抗體表面的負責抗原特性的氨基酸序列不同,每種抗體的互補決定區也不同,每種抗體的穩定性要求也不同,給解決蛋白質聚集問題帶來了很大挑戰。
5.4.腫瘤靶向和有效載荷釋放
相比于傳統的化學藥小分子,ADC因為偶聯了抗體顯然分子量要大得多,這樣會造成ADC穿透腫瘤微環境達到腫瘤細胞的效率有限。靜脈注射的ADC藥物最終能到達腫瘤組織的僅占2%,這也就是為什么在設計ADC時需要考慮載藥的性。一方面為了降低其它絕大多數不到達腫瘤組織的劇載藥帶來可能的系統性,抗體與載藥之間的連接子要足夠穩定,另一方面為了確保載藥進入細胞后能順利釋放,連接子也不能太穩定,因此在設計ADC的時候需要權衡這一點。ADC到達腫瘤組織后通過形成ADC-抗原復合物內化進細胞內部,酸性可裂解連接子的ADC被轉運到早期內吞體中,需要蛋白酶裂解的ADC會被轉運到晚期內吞體和溶酶體中。靶抗原表達的高異質性對于內化到細胞內的ADC抗腫瘤活性具有重要意義。在設計ADC的時候選用可裂解的非極性載藥可以有效穿越細胞膜,更好發揮ADC的“旁殺者效應”對周圍不表達抗原的腫瘤細胞發揮殺傷作用。
5.5.ADC的免疫原性
ADC是人工合成的生物大分子藥物,對于人體來說同樣屬于異物,具有誘導免疫原性的潛在風險,若進入人體后的ADC誘導產生的抗藥物抗體與人體內源的蛋白交叉反應會對ADC本身的臨床療效產生影響,這在臨床研究中必須予以評估。
5.6.耐藥性
抗原相關耐藥一方面是腫瘤細胞表面表達的靶抗原下調使ADC缺少識別的靶標無法發揮細胞性作用;另一方面靶抗原的高表達使腫瘤細胞表面暴露的ADC減少同樣會降低ADC的有效性比如外周血中表達過高的CD33抗原會消耗Mylotarg,從而限制其在骨髓中的滲透;其次,抗原胞外的結構域被截斷或腫瘤微環境中的細胞外基質成分阻擋了腫瘤細胞表面抗原的暴露同樣無法使ADC無法發揮細胞性作用;最后則是抗原配體的存在可以調節腫瘤細胞對ADC的敏感性。
腫瘤細胞內吞轉運ADC功能受損ADC需要被腫瘤細胞內吞到細胞內部而發揮療效,該過程通常通過clathrin-mediated、caveolin(CAV1-mediated、clathrin-caveolin非依賴性內吞等途徑完成,倘若腫瘤細胞無法正常內吞ADC會產生耐藥作用。
溶酶體功能障礙ADC進入細胞后到達溶酶體,被其中的酸性化學或者蛋白水解酶裂解釋放載藥發揮細胞殺傷作用。一方面若溶酶體pH增加,會抑制蛋白水解酶,從而產生耐藥作用,另一方面溶酶體膜對在溶酶體中ADC分解代謝產生的底物通透性差,使載藥不能進入細胞質從而也會產生耐藥作用。
載藥轉運蛋白藥物轉運蛋白ATPbindingcassettetransporters或MDR1將細胞質的載藥從細胞內轉運到細胞外使其無法發揮完成細胞殺傷作用。
靶點突變載藥作用的靶標蛋白結合位點發生突變。
細胞周期細胞周期動力學可能會影響腫瘤細胞對ADC的敏感性。研究發現處于分裂期的白細胞對Mylotarg的吸收更敏感,而沒有處于分裂期的白細胞不僅吸收Mylotarg低效而且對載藥刺孢霉素性作用不夠敏感。
激活信號通路下游信號通路的激活可能有助于增強腫瘤細胞對ADC的耐藥性,體外研究發現激活PI3K/AKT信號通路使得原代AML細胞對Mylotarg耐藥性增強。
細胞凋亡調節異常細胞凋亡調節的變化也會影響ADC的敏感性。研究發現無論是促凋亡蛋白BAX和BAK還是抗凋亡蛋白BCL-2、BCL-X都會影響AML細胞對Mylotarg的敏感性,體內研究顯示BCL-2蛋白的抑制劑ABT-263可以增強ADC的活性。
6.后DS-8201時代ADC藥物開發該何去何從?
雖然DS-8201在ADC時代極具統治力,但回顧歷史、分析當下,我們認為ADC賽道足夠廣闊,其他藥企還有機會,應堅定信心,迎難而上。ADC藥物集現代制藥工業之大成,開辟了腫瘤治療的新邊疆,宣告了立體腫瘤免疫時代已經來臨。ADC技術平臺雖然研發壁壘高,但外延價值大,可以組合迭代出豐富的產品組合,極大擴充研發管線,增加企業研發試錯的可選項和后續的發展潛力。國內藥企在ADC研發這一領域可以說開發熱情非常之高,從以百奧泰BAT8001為代表的第一代簡單粗暴模仿羅氏的T-DM1,到第二代以榮昌生物RC48為代表的對抗體、linker、payload進行有限改良,再到現在大力發展定點偶聯技術為代表的第三代ADC,總體來說保持了持續向好發展的態勢。
第一三共的DS-8201獲批上市以后給全球各大ADC開發企業都帶來了較大壓力,我們看到其競品無論是Seagen的HER2TKI產品tucatinib還是羅氏的HER2ADC產品T-DM1都受到了DS-8201快速成長帶來的沖擊,或調低銷售預期或趁DS-8201還未在中國市場上市利用時間差降價以快速搶占市場。T-DM1作為實體瘤治療領域的標桿性ADC藥物,是國內眾多藥企模仿學習的對象,T-DM1面對DS-8201尚且委曲求全,這讓眾多國內藥企情何以堪。但DS-8201并非完美無缺,首先從安全性方面來看,在多個適應癥中發現DS-8201會引發間質性肺炎,具有致死性,被FDA列入黑框警告;其次,DS-8201的價格不友好,在香港購買該藥品7-8萬/月,這讓絕大多數國內患者望而卻步。
創新者生,守舊者亡。面對DS-8201的壓力,我們看到已經出現了一些苗頭有望與之競爭。對于HER2陽性乳腺癌的后線治療新碼生物的ARX788I期劑量爬坡研究的結果患者的臨床獲益率不輸于DS-8201,但安全性卻更好;此外,針對HER2陽性實體瘤的泛癌種I期劑量遞增試驗中對于既往接受過T-DM1和DS-8201治療失敗的患者,ARX788仍能帶來臨床緩解。同樣科倫藥業的A166針對HER2陽性乳腺癌的后線治療I期劑量擴展研究中表現出對患者的臨床獲益率不輸于DS-8201,而且整體不良反應可控。由此可觀,DS-8201的技術路線并非是ADC開發的唯一優化路徑,在ADC這個領域是可以走出一條差異化發展之路的。
6.1.靶點多元化
目前無論是全球還是國內ADC研發在HER2等少數靶點上過度集中,造成嚴重內卷,靶點布局可以向常規競爭格局良好的靶點、突變蛋白靶點、雙靶點方向轉移。
6.1.1.常規競爭格局良好靶點
FRα:FRα在正常組織中表達較少,但卻在多種實體瘤中過度表達,目前尚無任何針對FRα靶點的藥品獲批上市。2020年10月,華東醫藥引進Immunogen靶向FRα的ADC新藥MirvetuximabSoravtansine的中國權益,該藥也是目前全球開發最快的FRαADC藥物,在FRα高表達的復發性卵巢癌患者中取得的積極數據有望加速其獲批上市,原研公司Immunogen正在開展III期臨床試驗。除了華東醫藥外,針對FRαADC2021年12月天士力引進了Sutro公司開發的STRO-002。STRO-002是一款第三代定偶聯ADC藥物,DAR值為4,產品均一性高,目前Sutro公司針對卵巢癌/子宮內膜癌正在開展I期臨床試驗。
EGFR:EGFR在多種腫瘤中過度表達,已成為多種成功上市的治療藥物的活躍靶標,目前尚無靶向EGFR的ADC產品上市。樂普生物的MRG003是目前國內處于臨床研究階段的首創的靶向EGFR的ADC藥物,有望填補EGFR靶向藥物二線及以上全身性治療失敗的EGFR陽性晚期或轉移性實體瘤患者未被滿足的醫療需求,在臨床上具有廣闊應用前景。I期劑量爬坡和劑量擴展試驗的結果顯示,MRG003在EGFR陽性頭頸部鱗癌和鼻咽癌患者中表現出可管理的安全性特征和有前景的抗腫瘤活性,在結直腸癌中需要進一步探索療效預測指標,尋找可能的獲益人群。研究者目前已在晚期SCCHN和NPC患者中啟動了II期臨床研究。
6.1.2.突變蛋白靶點
突變蛋白比野生型蛋白通常具有更高的泛素化水平意味著更容易被降解,而且它也更容易被細胞內化。如果選用致癌突變蛋白作為靶抗原,不僅可以提高腫瘤治療的特異性,還可以提高ADC的內化水平進而提高臨床療效。
6.1.3.雙靶點
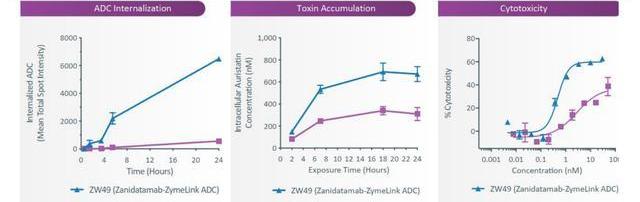
雙靶點特異性抗體技術為ADC創新帶來了新的可能,這種設計可以改善抗體內化并提高腫瘤特異性。Zymeworks利用其Azymetric和ZymeLink技術平臺開發的雙特異性抗體-藥物偶聯物(ADC)是在其開發的雙靶點特異性抗體Zanidatamab基礎上偶聯了載藥MMAE而成。ZW49目前正在進行一項I期臨床試驗,單藥治療局部晚期或轉移性HER2陽性實體瘤患者。研究發現相比于單靶點特異性抗體ADC,雙靶點特異性抗體ADC藥物ZW49在HER2表達的細胞內內化水平更高,募集的載藥更多,細胞性也更強。
6.2.適應癥的多元化
目前DS-8201在乳腺癌、胃癌、NSCLC等適應癥上表現出了強大的競爭實力,其他產品在適應癥上的布局上,一方面避免與DS-8201“撞車”,學習Mylotarg、T-DM1適應癥從后線向前線布局推進,另一方面要精準匹配適合藥物本身的適應癥人群。
6.2.1.避免與DS-8201“撞車”
國內ADC開發的情況是不少企業不僅在靶點上扎堆,而且在適應癥上也扎堆,現在DS-8201出來后這些“撞車”企業的壓力會很大。榮昌生物之所以能成為第一個國產ADC獲批的藥企,很大程度上歸功于適應癥的選擇。臨床急需,競爭格局良好的適應癥,不僅在開展臨床試驗時容易募集患者,節省研發成本,而且會加快研發進度,成功上市后,商業化前景也是可期。像RC48針對的胃癌、尿路上皮癌的后線治療,抑或是HER2低表達的乳腺癌都是如此。在適應癥的選擇上避開DS-8201的優勢項目,不僅降低將來與DS-8201做頭對頭試驗的風險,而且很可能通過單臂或者與化療做對照就可以申報上市,跑贏競爭對手。
6.2.2.前線后線治療全面開花
目前獲批的ADC大多針對的是適應癥的后線治療,然后逐步嘗試前移。通常來說前線比后線的患者人群要多,治療難度要小,因此藥企在考慮適應癥布局的時候不僅要盯著后線治療,還要考慮前線治療乃至輔助/新輔助治療。
6.2.3.精準匹配適應癥人群
ADC藥物是通過抗體去識別靶抗原進而殺死腫瘤細胞,但不同腫瘤細胞靶抗原的密度是不同的,對ADC的反應也是有差異的,有時候沒有觀察到臨床獲益可能只是群體的平均結果掩蓋了真相,細分人群中可能存在臨床獲益。華東醫藥引進的ImmunoGen靶向FRα的ADC新藥MirvetuximabSoravtansine,當初作為單藥治療鉑耐藥卵巢癌的療效和安全性的臨床III期研究FORWARDI,初次分析該臨床結果發現不限FRα表達狀態的全部入組人群中主要臨床終點PFS與化療組并無顯著性差異,隨后卻在FRα高表達的亞組患者中發現相比于化療對照組患者具有臨床獲益。由此可見,在適應癥的選擇上精準匹配適用人群對于ADC的成功開發也至關重要。
6.3.聯合治療前景廣闊
沒有一種抗腫瘤藥物可以100%有效,所以聯合不同作用機制的治療藥物以提高臨床獲益是當下開發腫瘤治療藥物的常用策略。既往研究顯示,化療藥物、小分子靶向藥物聯合抗PD-1/PD-L1單抗,療效通常高于抗PD1/PD-L1單藥本身。在ADC的臨床研究中發現了同樣的現象,多個臨床研究發現HER2ADC聯合抗PD-1單抗可以顯著提高療效。ADC類藥物也可與小分子或大分子抗血管生成藥物聯合使用。但值得注意的是,ADC本身攜帶細胞性分子,如果與其他化療藥物聯合使用,反而會增加安全隱患,因此化療藥物通常不作為ADC的首選聯合治療策略。
ADC通常的聯合給藥策略如下:抗血管生成劑,在一定程度上會改變腫瘤血管系統,從而改善ADC向腫瘤組織的遞送,增強ADC的細胞性作用;促進腫瘤細胞表面靶抗原表達的藥物可能會促進抗體-抗原結合,或者促進ADC-靶抗原復合體內化的藥物會增加腫瘤細胞攝取ADC從而增強細胞性;與ADC的載藥可以形成互補機制或合成致死作用的其他藥物可以進一步增強載藥的細胞性;促進募集激活的免疫效應細胞的藥物可以增強抗體依賴性細胞性作用或細胞介導的腫瘤識別和免疫效應功能,有助于增強ADC誘導的腫瘤殺傷作用。
6.4.泛偶聯極大豐富ADC的發展空間
時至今日,隨著技術的進步ADC不僅在結構上早已突破經典的抗體+連接子+載藥模式,核素偶聯藥物、小分子偶聯藥物、多肽偶聯藥物、雙環肽偶聯藥物、免疫刺激偶聯藥物、抗體偶聯siRNA、細胞偶聯抗體、多彈頭ADC等新概念ADC藥物如雨后春筍般冒出來,而且在應用場景上已不再局限于治療腫瘤,自身免疫疾病等其他適應癥也成為新的開發熱土。因而,掌握ADC平臺型技術的企業可以發揮的空間非常大,將在這個領域大展拳腳。
泛偶聯將小分子藥物與生物大分子藥物交叉組合在一起,使候選藥物分子的數量呈指數級爆炸增長,可以想象制藥工業將迎來蓬勃發展的新時代。但到目前為止,除了少數幾個多肽/核素偶聯藥物獲批上市之外,泛偶聯藥物還處于早期探索階段,發展并不樂觀。MersanaTherapeutics的靶向NaPi2b的用于治療卵巢癌的多彈頭ADC藥物UpifitamabRilsodotin,DAR高達10-12,臨床I期中期數據顯示該藥引發了嚴重的副作用,而且量效關系相反。BoltTherapeutics的HER2-TLR7/8ISAC藥物針對HER2陽性實體瘤的早期臨床試驗數據顯示患者的臨床獲益率很低,40例可評估患者中總緩解率ORR僅為2.5%。同樣致力于開發ISAC藥物的SilverbackTherapeutics的SBT6050與K藥聯用治療HER2陽性實體瘤的臨床I期數據顯示,患者的臨床獲益率也很低,14例可評估患者中總響應率ORR僅7%。總而言之,泛偶聯是一個新的制藥思路,給制藥企業帶來了更多探索的可能性,可以幫助制藥企業走出一條差異化發展之路。
6.5.小結
組成ADC的四大要素的理想特征是:抗體:靶向腫瘤特異抗原二者親和力高,細胞內化效率高、無免疫原性;連接臂:血液循環中穩定,細胞內可快速裂解;連接方式:定點偶聯,產生的ADC均一性高;載藥:性強,IC50值在0.01-0.1nM;水溶性強;血清中穩定。但在實際開發中我們不可能把每種最優的要素全部集合在一起,因為ADC本身是一個非常復雜的結構實體,CMC的可行性和難度對于最終能否開發出來一款成功的ADC藥物起了決定性作用。
正如每個人都有自己的能力圈,只能賺自己認知范圍內的錢一樣。對于ADC來說也是如此,不存在一款藥物可以通吃絕大多數適應癥也不僅僅只存在一種研發范式。不同的癌種微環境不同,靶標不同,選用何種抗體、載藥、連接子、連接方式都不可能照搬其他癌種的做法,ADC研發的根本原則就是立足于適應癥本身,實現安全性和有效性的有機統一,盡可能提高患者的治療窗口。所以,泛偶聯時代其他藥企仍然可以走出一條差異化發展之路。充分發揮自身優勢,遵循根本原則,滿足未被滿足的臨床需求,只要在某一點上取得突破可能就會有驚喜。后DS-8201時代,面對眼下肉眼可見的壓力,反而可以倒逼國內藥企思考做真正的創新與優化設計,并最終轉化為臨床上的高臨床價值藥物。
精選報告來源:。
最近啊,這個工信部曝光的新車申報圖確實是有蠻多,那本著替大家挑好車,以及未來這些新車上市后到底值不值得買的心態.
1900/1/1 0:00:00一、北放水遺址 所處時代:夏、東周、漢 北放水遺址位于河北省保定市唐縣高昌鎮北放水村西,面積約11萬平方米,遺址保存完好,文化層堆積包含物豐富,有先商和商代遺物,而先商亦是保定南部地區首次發現.
1900/1/1 0:00:00新民晚報訊前天中午12時許,市民王阿姨來到農行上海松江支行營業部,咨詢辦理數字人民幣個人二類錢包升級到一類錢包業務.
1900/1/1 0:00:00近日,幣圈爆出史上最大“黑天鵝”。市值曾高達410億美元、擁有幾十萬擁躉的LUNA幣,接連跳崖式暴跌,僅用幾天時間,價格就從近90美元跌到如今的0.00017美元,幾近歸零,幾百億美元市值瞬間蒸.
1900/1/1 0:00:00“加密貨幣”這個詞已經流行了很多年了,除了很多人都知道的“比特幣”之外,還有很多類似的加密貨幣,像“狗狗幣”、“以太幣”等等.
1900/1/1 0:00:00如今有很多人在思考如何才能將我們的社會和數學正確地關聯起來。難道數學僅僅是一個助你大學畢業、成功邁入職場,從而實現人生現實目標的工具?難道數學落在普羅大眾的手里只能是廢銅爛鐵,只有在精英人士的手.
1900/1/1 0:00:00